cho viên natri vào cốc nước thu một dung dịch chứa 16gam a viết phương trình hóa học của phản ứng b tính khối lượng riêng kim loại natri c tính thể tích khí thoát ra ở điều kiện tiêu chuẩn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Na}=\dfrac{4.6}{23}=0.2\left(mol\right)\)
\(n_K=\dfrac{3.9}{39}=0.1\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
\(V_{H_2}=\left(\dfrac{0.2}{2}+\dfrac{0.1}{2}\right)\cdot22.4=3.36\left(l\right)\)
\(m_{bazo}=0.2\cdot40+0.1\cdot56=13.6\left(g\right)\)

a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
b)
Theo PTHH : $n_{Mg} = n_{MgSO_4} = n_{H_2SO_4} = 0,14.1,2 = 0,168(mol)$
$m_{Mg} = 0,168.24 = 4,032(gam)$
$m_{MgSO_4} = 0,168.120 = 20,16(gam)$
c)
$n_{H_2} = n_{H_2SO_4} = 0,168(mol)$
$V_{H_2} = 0,168.22,4=3,7632(lít)$

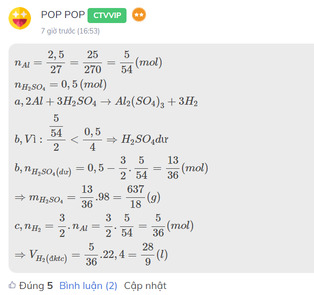
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

a) Zn + 2HCl --> ZnCl2 + H2
b) \(n_{Zn}=\dfrac{1,3}{65}=0,02\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,02-->0,04---------->0,02
=> VH2 = 0,02.22,4 = 0,448 (l)
c) mHCl = 0,04.36,5 = 1,46 (g)

Số mol của 5,6g Fe:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
a,\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b,thể tích của 0,1 mol H2:
\(V_{H_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
c,\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
khối lượng của 0,1 mol Cu:
\(m_{Cu}=n.M=0,1.64=6,4\left(g\right)\)

\(n_{HCl}=\dfrac{18.25}{36.5}=0.5\left(mol\right)\)
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\)
\(b.\)
\(n_{Mg}=n_{H_2}=\dfrac{1}{2}\cdot n_{HCl}=\dfrac{1}{2}\cdot0.5=0.25\left(mol\right)\)
\(m_{Mg}=0.25\cdot24=6\left(g\right)\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(c.\)
\(V_{H_2\left(tt\right)}=5.6\cdot90\%=5.04\left(l\right)\)
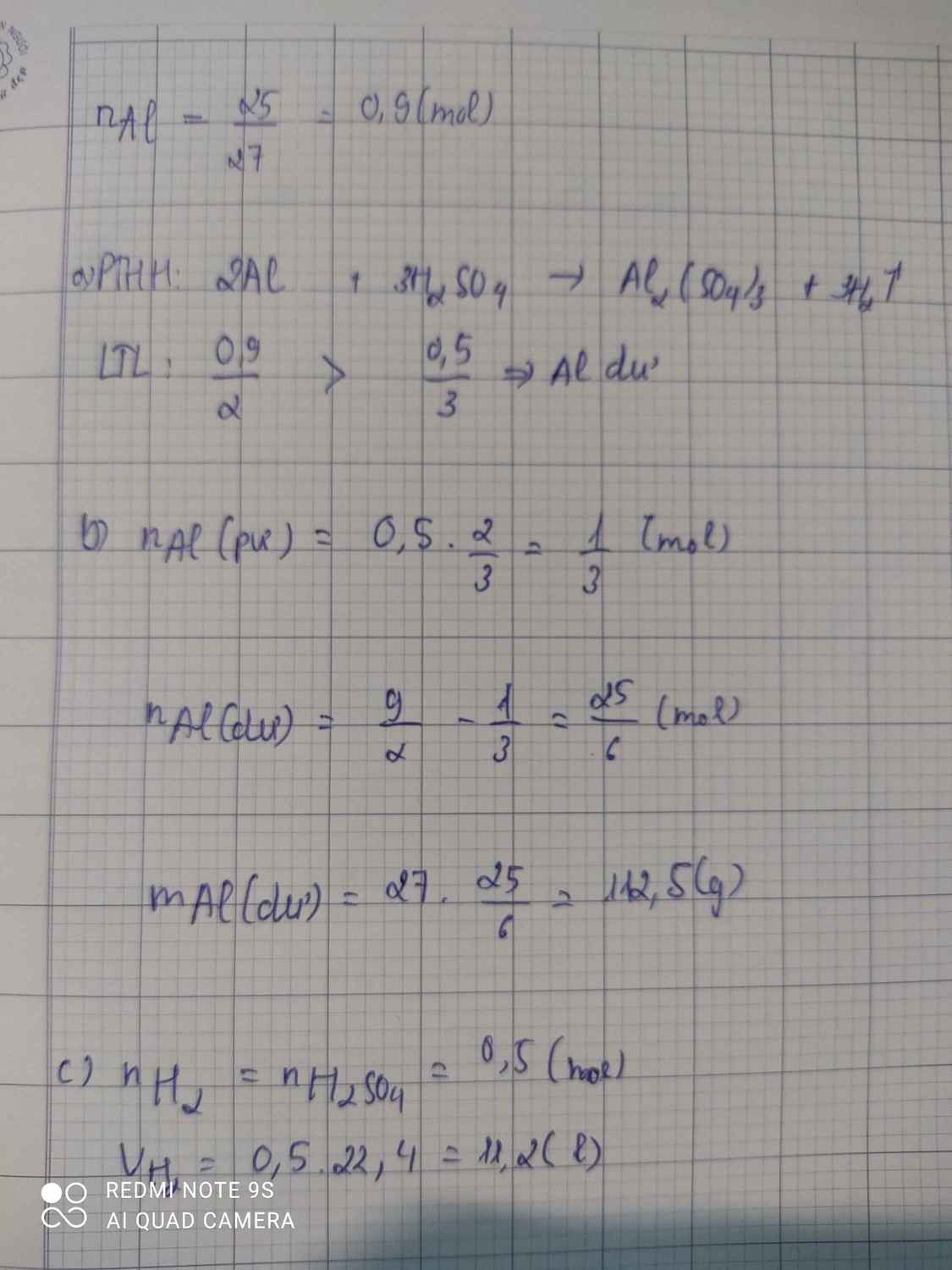
pthh 2Na + 2H2O ---> 2NaOH + H2
nNaOH = 16 : 40 = 0,4 (mol)
theo pthh , nNa = nNaOH = 0,4(mol)
=> mNa = 0,4 . 23 = 9,2 (g)
theo pthh , nH2 = 1/2 nNa = 0,2 (mol)
=> VH2 = 0,2 . 22,4 = 4,48 (l)