Khử hoàn toàn 3,2 gam sắt (3) oxit = khí hiđro
a) viết pt hóa học của phản ứng
b) tính thể tích khí hiđro (đktc) cần dùng
c) tính khối lượng kim loại sắt thu đc sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a ) \(n_{Fe_2O_4}=\frac{23,2}{232}=0,1\) mol
\(Fe_3O_4+4H_2\underrightarrow{t^0}3Fe+4H_2O\)
0,1 -> 0,4 -> 0,3
\(\Rightarrow n_{H_2}=4n_{Fe_3O_4}=0,4\) mol \(\Rightarrow V_{H_2}=0,4.22,4=8,96\) lít
b ) \(n_{Fe}=3n_{Fe_3O_4}=0,3\) mol \(\Rightarrow m_{Fe}=56.0,3=16,8\) gam.

Ta có: \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
_____0,3_____0,9___0,6____0,9 (mol)
a, \(m_{Fe}=0,6.56=33,6\left(g\right)\)
b, \(V_{H_2}=0,9.22,4=20,16\left(l\right)\)
c, PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2O}=0,9\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,9.22,4=20,16\left(l\right)\)

hình như bn ghi sai r đó phải là:đồng oxit mới phải chứ![]()

CuO+H2-to>Cu+H2O
0,09----0,09---0,09
n CuO=\(\dfrac{7,2}{80}\)=0,09 mol
=>m Cu=0,09.64=5,76g
=>VH2=0,09.22,4=2,016l
\(n_{CuO}=\dfrac{7,2}{80}=0,09mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,09 0,09 0,09 ( mol )
\(m_{Cu}=0,09.64=5,76g\)
\(V_{H_2}=0,09.22,4=2,016l\)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)

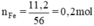
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe}=\dfrac{24}{56}=\dfrac{3}{7}\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=\dfrac{3}{14}\left(mol\right)\Rightarrow m_{Fe_2O_3}=\dfrac{3}{14}.160=\dfrac{240}{7}\left(g\right)\)
c, Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Fe}=\dfrac{9}{14}\left(mol\right)\Rightarrow V_{H_2}=\dfrac{9}{14}.22,4=14,4\left(l\right)\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{24}{56}\approx0,43\left(mol\right)\\ a.PTHH:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
2 3 2 3
0,43 0,645 0,45 0,645
\(b.m_{Fe_2O_3}=n.M=0,43.\left(56.2+16.3\right)=68,8\left(g\right)\\ c.V_{H_2}=n.24,79=0,645.24,79=15,98955\left(l\right).\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{3,2}{160}=0,02mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 ( mol )
\(V_{H_2}=n.22,4=0,06.22,4=1,334l\)
\(m_{Fe}=n.M=0,04.56=2,24g\)
nFe2O3 = 3,2/160 = 0,02 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
Mol: 0,02 ---> 0,06 ---> 0,04
VH2 = 0,06 . 22,4 = 1,344 (l)
mFe = 0,04 . 56 = 2,24 (g)