Cho 19,8g hỗn hợp 2 kim loại Al và Mg tác dụng hoàn toàn với dung dịch HCl dư thu được 20,16 lít khí H2(đktc). Xác định phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

Đáp án : A
+) HCl : Al -> 1,5H2
Mg -> H2
+) NaOH : Al -> 1,5H2
=> nAl = 2/3 nH2 = 0,2 mol
=> nMg = nH2(1) – nH2(Al) = 0,4 – 0,3 = 0,1 mol
=> %mAl = 69,23%

- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 7,8 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 2x + 3y = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,4}{7,8}.100\%\approx30,77\%\\\%m_{Al}\approx69,23\%\end{matrix}\right.\)
b, BTNT Mg và Al, có:
nMgCl2 = nMg = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MgCl_2}=\dfrac{0,1.95}{0,1.95+0,2.133,5}.100\%\approx26,24\%\\\%m_{AlCl_3}\approx73,76\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án A
Đặt nFe = a và nAl = b.
+ Phương trình theo khối lượng hỗn hợp: 56a + 27b = 9,65 (1)
+ Phương trình bảo toàn e là: 2a + 3b = 2nH2 = 0,65 (2)
+ Giải hệ (1) và (2) ⇒ nAl = b = 0,15 mol
⇒ %mAl = 0,15×27/9,65 × 100 ≈ 41,97%

Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
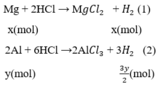
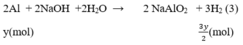
Số mol H2
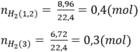
Theo bài ra ta có hệ phương trình:
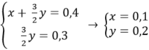
mMg = 24.0,1 = 2,4(g)
mAl = 27.0,2 = 5,4(g)



\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{20,16}{22,4}=0,9mol\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\\n_{Mg}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=27x\\m_{Mg}=24y\end{matrix}\right.\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x \(\dfrac{3}{2}x\) ( mol )
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}27x+24y=19,8\\\dfrac{3}{2}x+y=0,9\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
\(\Rightarrow m_{Mg}=0,6.24=14,4g\)
\(\%m_{Al}=\dfrac{5,4}{19,8}.100=27,27\%\)
\(\%m_{Mg}=100\%-27,27\%=72,73\%\)