Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,4 0,4
\(m_{Fe}=0,4.56=22,4\left(g\right)\)
\(m_{hh}=22,4+5=27,4\left(g\right)\)
\(\%m_{Fe}=\dfrac{22,4.100\%}{27,4}=81,75\%;\%m_{Cu}=100-81,75=18,25\%\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
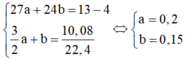
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

a) Theo đề bài: \(m_{Cu}=0,3\left(g\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
a______2a______a_____a (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b_____2b______b____b (mol)
Ta lập được hệ phươn trình: \(\left\{{}\begin{matrix}24a+56b=18,7-0,3=18,4\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3\cdot24=7,2\left(g\right)\\m_{Fe}=0,2\cdot56=11,2\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{0,3}{64}=\dfrac{3}{640}\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=\dfrac{3}{640}\cdot22,4=0,105\left(l\right)\)
a)
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(mol)$
$m_X = 24a + 56b = 0,3 = 18,7(gam)$
Suy ra a = 0,3 ; b = 0,2
$m_{Mg} = 0,3.24 = 7,2(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$n_{SO_2} = n_{Cu} = \dfrac{0,3}{64}$
$V = \dfrac{0,3}{64}.22,4 = 0,105(lít)$

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

Gọi số mol Fe, Al là a,b
Khối lượng kim loại không tan là khối lượng của Cu
=> 56a + 27b = 9,08-2,4 = 6,68(g)
\(n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
______a------------------------>a
2Al + 6HCl --> 2AlCl3 + 3H2
_b------------------------->1,5b
=>a + 1,5b = 0,16 (mol)
=> a = 0,1; b = 0,04
=> mFe = 0,1.56 = 5,6 (g)
=> mAl = 0,04.27 = 1,08(g)
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)