Bài 1. Chia 156,8 gam hỗn hợp X gồm FeO, MgO, Al2O3, Fe2O3, Fe3O4 thành hai phần bằng nhau. Cho phần 1
phản ứng hết với dd H2SO4 loãng dư thu được 190,4 gam muối khan. Phần 2 phản ứng vừa đủ với dd Y gồm
HCl và H2SO4 loãng thu được 175,4 gam muối khan. Số mol của H2SO4 trong dd Y là
Bài 2 Cho 15,8 gam hỗn hợp X gồm Mg, Al, Zn và Fe phản ứng với dung dịch HCl dư thu được 13,44 lít khí H2
ở đkc. Mặt khác, nếu cho 15,8 gam hỗn hợp X này phản ứng với khí clo dư đến khi phản ứng hoàn toàn thấy thu
được 61,95 gam hỗn hợp muối khan. % khối lượng của Fe trong hỗn hợp X là

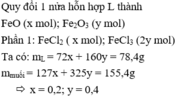


Bài 1:
TN1: moxit = 78,4 (g)
Gọi số mol H2SO4 pư là a (mol)
=> \(n_{H_2O}=a\left(mol\right)\) (Bảo toàn H)
Theo ĐLBTKL: \(m_{oxit}+m_{H_2SO_4}=m_{muối}+m_{H_2O}\)
=> 78,4 + 98a = 190,4 + 18a
=> a = 1,4 (mol)
=> \(n_O=n_{H_2O}=1,4\left(mol\right)\)
=> mkim loại = moxit - mO = 78,4 - 1,4.16 = 56 (g)
TN2:
Gọi \(\left\{{}\begin{matrix}n_{HCl}=x\left(mol\right)\\n_{H_2SO_4}=y\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: \(n_{H_2O}=\dfrac{x+2y}{2}=1,4\left(mol\right)\)
=> x + 2y = 2,8 (1)
Có: \(m_{muối}=m_{kim.loai}+m_{Cl}+m_{SO_4}\)
=> 175,4 = 56 + 35,5x + 96y
=> 35,5x + 96y = 119,4 (2)
(1)(2) => x = 1,2; y = 0,8
Vậy số mol H2SO4 trong Y là 0,8 (mol)
Bài 2:
Gọi số mol Fe trong 15,8 gam X là a (mol)
TN1:
Bảo toàn Fe: \(n_{FeCl_2}=a\left(mol\right)\)
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
=> nHCl = 1,2 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 15,8 + 1,2.36,5 - 0,6.2 = 58,4 (g)
TN2:
Bảo toàn Fe: \(n_{FeCl_3}=a\left(mol\right)\)
Khối lượng muối tăng: 61,95 - 58,4 = 3,55 (g)
=> \(m_{FeCl_3}-m_{FeCl_2}=3,55\)
=> 162,5a - 127a = 3,55
=> a = 0,1 (mol)
\(\%m_{Fe}=\dfrac{0,1.56}{15,8}.100\%=35,443\%\)