cho 26 gam kẽm tác dụng vừa đủ với dung dịch axit clohiđric Hãy tính thể tích khí Hiđro sinh ra với khí hidro thu được trên sẽ khử được bao nhiêu gam đồng oxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,25-------------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b)
PTHH: CuO + H2 --to--> Cu + H2O
0,25--->0,25
=> mCu = 0,25.64 = 16 (g)

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH :
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,PTHH:\)
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
trc p/u: 0,3 0,12
p/u: 0,3 0,1 0,2 0,3
sau : 0 0,02 0,2 0,3
----> Fe2O3 dư
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
\(n_{Fe}=0,2.56=11,2\left(g\right)\)

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=n_{Mg}=0,2\left(mol\right)\\ n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\\ CuO+H_2\underrightarrow{^{to}}Cu+H_2O\\ Vì:\dfrac{0,25}{1}>\dfrac{0,2}{1}\\ \Rightarrow CuOdư\\ \Rightarrow n_{Cu}=n_{H_2}=0,2\left(mol\right)\\ m_{Cu}=0,2.64=12,8\left(g\right)\)
\(n_{Mg}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,2 0,2
\(n_{H2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
Pt : \(H_2+CuO\rightarrow\left(t_o\right)Cu+H_2O|\)
1 1 1 1
0,2 0,25 0,2
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\)
⇒ H2 phản ứng hết , CuO dư
⇒ Tính toán dựa vào số mol của H2
\(n_{Cu}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{Cu}=0,2.64=12,8\left(g\right)\)
Chúc bạn học tốt

a) số mol của 19,5 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Tỉ lệ : 1 : 1 : 1 : 1
0,3-> 0,3 : 0,3 : 0,3
thể tích của 0,3 mol H2:
\(V_{H_2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
b) số mol của 19,2 gam Fe2O3:
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH:
\(3H_2+Fe_2O_3\underrightarrow{t^o}2Fe+3H_2O\)
3 : 1 : 2 : 3
0,12-> 0,04 : 0,08 : 0,12 (mol)
Khối lượng của 0,08 mol Fe:
\(m_{Fe}=n.M=0,08.56=4,48\left(g\right)\)
PTHH: Zn + 2HCl ---> ZnCl₂ + H₂
1 2 1 1 ( mol)
a):Số mol Zn: nZn = 19,5 ÷ 65 = 0,3 mol.
Theo PTHH => Số mol H₂: nH₂ = 0,3 × 1 ÷ 1 = 0,3 mol
=> Thể tích H₂ (đktc): V = n × 22,4 = 0,3 × 22,4 = 6,72 lít
b) PTHH: Fe₂O₃ + 3H₂ --> 2Fe + 3H₂O
1 3 2 3 (mol)
*Lm tương tự nhưng thay vì tính thể tích thì tính KL Fe

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3
\(V_{H_2}=0,3.22,4=6,72l\\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12g\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ LTL:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\
m_{Fe}=0,2.56=11,2g\)
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,12 > 0,3 ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)

a) \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,4-->0,8----->0,4--->0,4
=> VH2 = 0,4.22,4 = 8,96 (l)
b) mZnCl2 = 0,4.136 = 54,4 (g)
c) \(C\%=\dfrac{0,8.36,5}{200}.100\%=14,6\%\)

2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----------------------------------0,3
n Al=0,2 mol
=>VH2=0,3.22,4=6,72l
b)
XO+H2-to>X+H2O
0,3-------------0,3
=>0,3=\(\dfrac{19,5}{X}\)
=>X là Zn( kẽm)
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_X=\dfrac{19,5}{M_X}\)
\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(\dfrac{19,5}{M_X}\) \(\dfrac{19,5}{M_X}\) ( mol )
Ta có:
\(\dfrac{19,5}{M_X}=0,3\)
\(\Leftrightarrow M_X=65\)
=> X là kẽm (Zn)

\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(.........0.6............0.3\)
\(C_{M_{HCl}}=\dfrac{0.6}{0.3}=2\left(M\right)\)
\(n_{Fe_2O_3}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{t^0}}2Fe+3H_2O\)
\(1..............3\)
\(0.3..........0.3\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.3}{3}\Rightarrow Fe_2O_3dư\)
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}\cdot0.3=0.2\left(mol\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\)
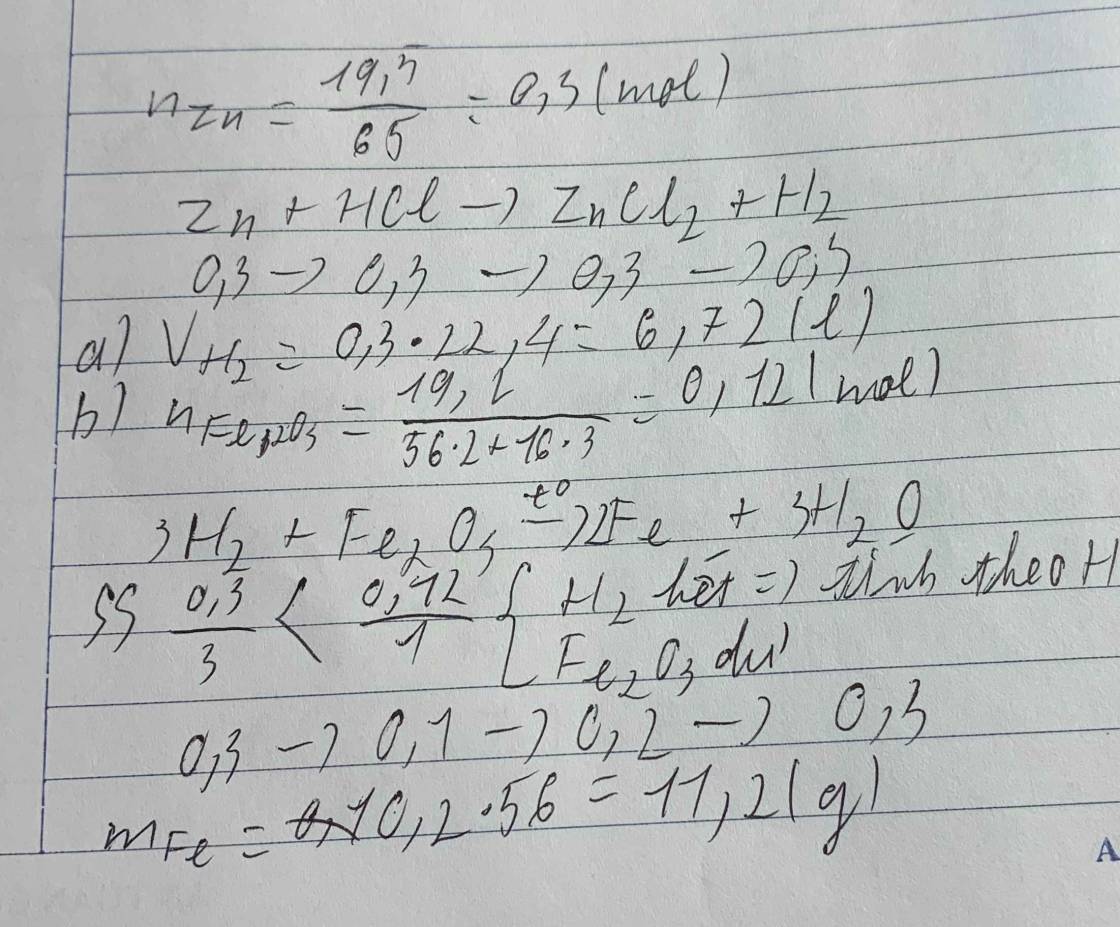
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)=n_{H_2}=n_{CuO}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=0,4\cdot80=32\left(g\right)\\V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\end{matrix}\right.\)
\(Zn + 2HCl \to ZnCl_2 + H_2\\ n_{H_2} = n_{Zn} = \dfrac{26}{65} = 0,4(mol)\\ \Rightarrow V_{H_2} = 0,4.22,4 = 8,96\ lít\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{CuO} = n_{H_2} = 0,4(mol)\\ \Rightarrow m_{CuO} = 0,4.80 = 32\ gam\)