Cho 22,7 gam hỗn hợp A gồm Zn và ZnO tác dụng với dung dịch
H2SO4 (dư) thu được 2,24 lít khí (ở đktc).
a. Viết PTHH của phản ứng.
b. Tính khối lượng mỗi chất trong hỗn hợp A.
c. Tính nồng độ mol/l của 200ml dung dịch H2SO4 vừa đủ để hòa tan hoàn toàn 22,7g hỗn hợp A.


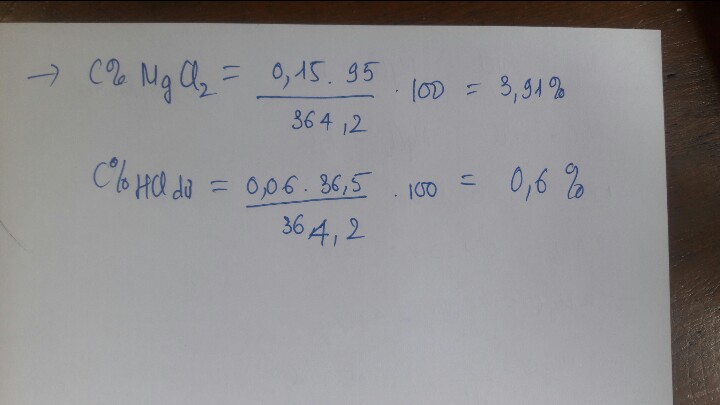


a) PTHH : \(Zn+H_2SO_4-->ZnSO_4+H_2\uparrow\) (1)
\(ZnO+H_2SO_4-->ZnSO_4+H_2O\) (2)
b) Theo pthh (1) : \(n_{Zn}=n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(m_{Zn}=0,1.65=6,5\left(g\right)\)
=> \(m_{ZnO}=22,7-6,5=16,2\left(g\right)\)
c) \(ZnO=\dfrac{16,2}{81}=0,2\left(mol\right)\)
Theo pthh (1) và (2) : \(\Sigma n_{H2SO4}=n_{Zn}+n_{ZnO}=0,1+0,2=0,3\left(mol\right)\)
=> \(C_{M\left(ddH2SO4\right)}=\dfrac{0,3}{0,1}=1,5M\)
a) PTHH : Zn+H2SO4−−>ZnSO4+H2↑Zn+H2SO4−−>ZnSO4+H2↑ (1)
ZnO+H2SO4−−>ZnSO4+H2OZnO+H2SO4−−>ZnSO4+H2O (2)
b) Theo pthh (1) : nZn=nH2=2,2422,4=0,1(mol)nZn=nH2=2,2422,4=0,1(mol)
=> mZn=0,1.65=6,5(g)mZn=0,1.65=6,5(g)
=> mZnO=22,7−6,5=16,2(g)mZnO=22,7−6,5=16,2(g)
c) ZnO=16,281=0,2(mol)ZnO=16,281=0,2(mol)
Theo pthh (1) và (2) : ΣnH2SO4=nZn+nZnO=0,1+0,2=0,3(mol)ΣnH2SO4=nZn+nZnO=0,1+0,2=0,3(mol)
=> CM(ddH2SO4)=0,30,1=1,5M
tích đúng đê