Cho 10 mL dung dịch hỗn hợp HNO3 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa dung dịch axit trên là
A. 0,02 lít.
B. 0,01 lít.
C. 0,05 lít.
D. 0,04 lít.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


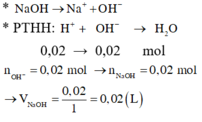

Đáp án D
nOH-= 2nH2= 1,2 mol
ð nH+= 1,2 mol
Gọi thể tích dung dịch axit là x (lít)
nH+= 0,5.2x+x = 2x
ð 2x=1,2
ð x=0,6

Đáp án D
Trong dung dịch axit, ta có :
n Cl - = n HCl = 0 , 3 mol
n SO 4 2 - = n H 2 SO 4 = 0 , 15 mol
Sơ đồ phản ứng :

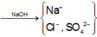
Cho NaOH vào X để thu được kết tủa lớn nhất thì dung dịch sau phản ứng chỉ còn các ion Na + , Cl - và SO 4 2 - .
Áp dụng bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố Na, ta có :
n NaOH = n Na + = n Cl - + 2 n SO 4 2 - = 0,6 mol
→ V dd NaOH 1 M = 0,6 lit = 600ml

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

$n_{HNO_3} = 0,3.1 = 0,3(mol)$
$n_{NO_2} = \dfrac{1,12}{22,4} = 0,05(mol)$
$2H^+ + NO_3^- + 1e \to NO_2 + H_2O$
$n_{HNO_3\ pư} = n_{H^+} = 2n_{NO_2} = 0,1(mol)$
$\Rightarrow n_{HNO_3\ dư} = 0,3 - 0,1 = 0,2(mol)$
Gọi $V_{dd\ B} = x(lít) \Rightarrow n_{NaOH} = 0,01x(mol) ; n_{Ba(OH)_2} = 0,02x(mol)$
mà: $n_{HNO_3\ dư} = n_{NaOH} + 2n_{Ba(OH)_2}$
$\Rightarrow 0,2 = 0,01x + 0,02x.2$
$\Rightarrow x = 4(lít)$