Cho 1, 44 gam một kim loại M chứ biết hoá trị tác dụng với dung dịch HCl dư thu được 2.688 lít H2 ở đktc tìm M trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2M + 6 HCl -> 2 MCl2 + 3 H2
nH2=10,08/22,4=0,45(mol)
=>nM=0,3(mol)
=>M(M)=8,1/0,3=27(g/mol)
=>M(III) cần tìm là nhôm (Al=27)

Câu 1:
A2O3 + 3H2 -t0-> 2A + 3H2O
2A+48...................2A
16..........................11.2
<=> 11.2 * (2A + 48) = 16 * 2A
=> A = 56
Vậy A là : Fe
đó là 2 bài riêng biệt
Xác định tên nguyên tố
Bài 1.Dùng H2 khử 16gam oxit kim loại hóa trị III, thu được 11,2gam kim loại A. Xác định A
Bài 2.Cho 8,1 gam kim loại M tác dụng với dung dịch HCL dư thu được 10,08 lít H2 ở đktc. Xác định kim loại M biết M hóa trị III

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
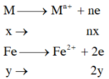
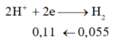
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
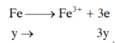
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C


Ta có bảng sau:
n |
1 |
2 |
3 |
4 |
M |
21 (loại) |
42 (loại) |
63 (loại) |
84 (loại) |
=> loại trường hợp này


Gọi CT oxit là M2Om
Mol H2 TN1=0,06 mol
Mol H2 TN2=0,045 mol
M2Om + mH2→ 2M + mH2O
0,06/m mol<=0,06 mol. =>0,12/m mol
=>0,06(2M+16m)/m=3,48
2M + 2nHCl→ 2MCln + nH2
0,12/m mol. 0,045 mol
⇒⇒0,045.2/n=0,12/m⇒⇒m=8/3; n=2 tm
Thay m=8/3 vào công thức tính m có M=56 FeFe
Oxit là Fe3O4 vì n=8/3





Gọi x là hóa trị của M.
Ta có: \(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
\(PTHH:2M+2xHCl--->2MCl_x+xH_2\uparrow\)
Theo PT: \(n_M=\dfrac{2}{x}.n_{H_2}=\dfrac{2}{x}.0,12=\dfrac{0,24}{x}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{1,44}{\dfrac{0,24}{x}}=6x\left(g\right)\)
Biện luận:
Vậy M là kim loại magie (Mg)