Một hỗn hợp X gồm Mg và Fe, để thu được kim loại Fe từ hỗn hợp (giữ nguyên khối lượng Fe ban đầu), ta cho hỗn hợp X tác dụng lần lượt với lượng dư các dung dịch
![]()
![]()
![]()
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cu không tác dụng với dung dịch HCl nên 12,8 gam là khối lượng của Cu.
n HCl = 91,25x20/(100x36,5) = 0,5 mol
Phương trình hóa học:
Mg + 2HCl → Mg Cl 2 + H 2
Fe + 2HCl → Fe Cl 2 + H 2
n Mg = x
n Fe = y
Ta có các phương trình:
24x + 56y = 23,6 - 12,8 = 10,8 (I)
2x + 2y = 0,5 (II)
Giải phương trình (I), (II) ta tìm được x và y:
x = 0,1; y = 0,15; m Mg = 2,4g; m Fe = 8,4g

Đáp án D
Các phản ứng xảy ra:
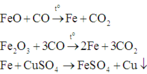
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
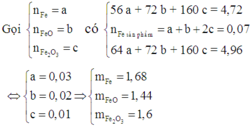

\(a.Fe+2HCl\rightarrow FeCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ b.Chấtrắnkhôngtan:Cu\\ \%m_{Cu}=54,24\%\\ Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}2x+2y=\dfrac{91,25.20\%}{36,5}\\56x+24y=23,6-12,8\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=35,59\%\\\%m_{Mg}=10,17\%\end{matrix}\right.\)

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
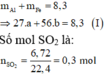
Sơ đồ phản ứng:
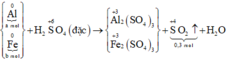
Các quá trình nhường, nhận electron:


Bài 1:
a+b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{11,2}{17,6}\cdot100\%\approx63,64\%\\\%m_{Cu}=36,36\%\end{matrix}\right.\)
c) Ta có: \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)=n_{CuSO_4}\)
\(\Rightarrow m_{muối}=0,1\cdot400+0,1\cdot160=56\left(g\right)\)
Bài 2:
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=27,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,39\\b=0,36\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,195\left(mol\right)\) \(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,195\cdot400=78\left(g\right)\)

Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(\overset{o}{Fe}\rightarrow\overset{+2}{Fe}+2e\) \(\overset{+1}{2H}+2e\rightarrow\overset{0}{H_2}\)
x - - - - - -> 2x (mol) 1.2 < - - 0,6
\(\overset{0}{Mg}\rightarrow\overset{+2}{Mg}+2e\)
y - - - - - - - > 2y (mol)
Bảo toàn electron: \(2x+2y=1,2\)
Mà \(56x+24y=20,8\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2\cdot56}{20,8}\cdot100\%\approx53,85\%\\\%m_{Mg}=46,15\%\end{matrix}\right.\)

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)
Chọn D
Đáp án A sai, vì lượng Fe tạo thành nếu cho tiếp H 2 S O 4 dư vào thì Fe bị hòa tan hết.
Đáp án B sai, vì C u S O 4 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được kim loại Cu.
Đáp án c sai, vì A g N O 3 sẽ phản ứng hết với Mg và Fe dẫn đến chỉ thu được Ag và AgI.
Đáp án D đúng, vì khi Z n 2 + dư loại hết Mg ra thì Zn tiếp tục bị hòa tan bới NaOH thu được Fe