Cho a mol Fe phản ứng vừa đủ với b mol H2SO4 (đặc, nóng) thu được khí SO2 (sản phẩm khử duy nhất) và 5,04 gam muối. Biết tỉ lệ a : b = 3 : 7. Giá trị của a là
A. 0,03.
B. 0,02.
C. 0,025.
D. 0,05
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

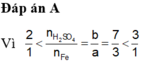
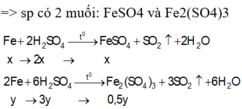
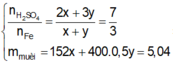
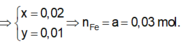

Đáp án A
Muối gồm:
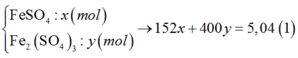
Số mol e nhường = 2x + 6y à Số mol SO2 = x+ 3y
à Số mol H2SO4 phản ứng = 2x + 6y (mol)
Theo bài ra ta có :
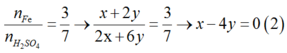
Giải (1) và (2) ta được :
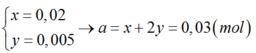

2 Fe + 2n H2SO4 --> Fe2(SO4)n + n SO2 + n H2O
a------------an-----------0,5a
số mol Fe bằng 37,5% => a = 0,375*na => n = 2,667 khối lượng muối = 0,5a(56+96n) = 8,28 => a = 0,045 khối lượng Fe = 56*0,045 = 2,52
=> Đáp án A

Quy đổi hỗn hợp kim loại thành R, có soh là +n
\(n_R=\dfrac{17,1}{M_R}\left(mol\right)\)
R0 - ne --> R+n
\(\dfrac{17,1}{M_R}\)->\(\dfrac{17,1n}{M_R}\)
S+6 + 2e --> S+4
1<---0,5
Bảo toàn e: \(\dfrac{17,1n}{M_R}=1\Rightarrow M_R=17,1n\)
Muối thu được có CTHH là R2(SO4)n
\(n_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(mol\right)\)
=> \(m_{R_2\left(SO_4\right)_n}=\dfrac{17,1}{2.M_R}\left(2.M_R+96n\right)=17,1+\dfrac{820,8n}{M_R}=65,1\left(g\right)\)

a) Gọi nCu = a (mol) => nFe = a (mol)
=> 64a + 56a = 12
=> a = 0,1 (mol)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,1------------------------------------------->0,1
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1--------------------------------------------------->0,3
=> VSO2 = (0,3 + 0,1).22,4 = 8,96 (l)
b) \(n_{hh}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{hh}=24,5.2=49\left(\dfrac{g}{mol}\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{SO_2}}{n_{H_2S}}=\dfrac{V_{SO_2}}{V_{H_2S}}=\dfrac{64-49}{49-34}=\dfrac{1}{1}\)
\(\rightarrow n_{SO_2}=n_{H_2S}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
2R + 2nH2SO4 (đặc, nóng) ---> R2(SO4)n + nSO2 + 2nH2O
\(\dfrac{0,1}{n}\)<------------------------------------------------0,05
8R + 5nH2SO4 (đặc, nóng) ---> 4R2(SO4)n + nH2S + 4nH2O
\(\dfrac{0,4}{n}\)<-------------------------------------------------0,05
\(\rightarrow n_R=\dfrac{0,1}{n}+\dfrac{0,4}{n}=\dfrac{0,5}{n}\left(mol\right)\\ \rightarrow M_R=\dfrac{4,5}{\dfrac{0,5}{n}}=9n\left(\dfrac{g}{mol}\right)\)
Xét n = 3 thoả mãn => MR = 27 (g/mol)
Vậy R là Al

nFe= (dfrac{6,72}{56})= 0,12 (mol)
2 Fe + 6 H2SO4(đặc,nóng) → Fe2(SO4)3 + 3 SO2↑ + 6 H2O
mol 0,12 0,3
p.ứ 0,1 0,3
sau p.ứ 0,02 0 0,05
Vậy sau p.ứ thu đc 0,05 mol Fe2(SO4)3 và 0,02 mol Fe dư (ý B)
Bài làm của e chưa chính xác. Đối với trường hợp này thì Fe dư sẽ tiếp tục tác dụng với Fe2(SO4)3 để tạo ra FeSO4. Sản phẩm muối của bài này gồm có : Fe2(SO4)3 và FeSO4

Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Chọn đáp án D
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18