Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng: 2Fe + 6H2SO4 → 1Fe2(SO4)3 + 3SO2↑ + 6H2O.
nFe = 0,12 mol; nH2SO4 = 0,3 mol
⇒ từ tỉ lệ phản ứng → Fe dư, H2SO4 hết.
Fe dư 0,02 mol → xảy ra phản ứng: Fe + Fe2(SO4)3 → 3FeSO4.
Theo đó, muối thu được gồm 0,06 mol FeSO4 và 0,03 mol Fe2(SO4)3.
⇒ mmuối = 0,06 × 152 + 0,03 × 400 = 21,12 gam.
Đáp án B

Quy đổi hỗn hợp X gồm a mol Fe2O3 và b mol FeO. Do đó n F e 2 ( S O 4 ) 3 = a v à n F e S O 4 = b
Theo giả thiết a = 2b ⇒hỗn hợp X gồm 2b mol Fe2O3 và b mol FeO.
Trong 39,2 gam hỗn hợp X gồm 2b’ mol Fe2O3 và b’ mol FeO ⟹ 320b'+72b' = 39,2
⟹ b’ = 0,1 ⟹ nFeO = 0,1
![]()
⟹ V = 1,12 (lít)
Đáp án C


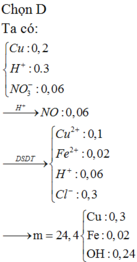
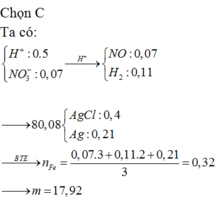
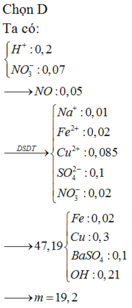
nFe= (dfrac{6,72}{56})= 0,12 (mol)
2 Fe + 6 H2SO4(đặc,nóng) → Fe2(SO4)3 + 3 SO2↑ + 6 H2O
mol 0,12 0,3
p.ứ 0,1 0,3
sau p.ứ 0,02 0 0,05
Vậy sau p.ứ thu đc 0,05 mol Fe2(SO4)3 và 0,02 mol Fe dư (ý B)
Bài làm của e chưa chính xác. Đối với trường hợp này thì Fe dư sẽ tiếp tục tác dụng với Fe2(SO4)3 để tạo ra FeSO4. Sản phẩm muối của bài này gồm có : Fe2(SO4)3 và FeSO4