Nung nóng hỗn hợp gồm 0,5 mol N2 và 1,5 mol H2 trong bình kín (có xúc tác) rồi đưa về nhiệt độ toC thấy áp suất trong bình lúc này là P1. Sau đó cho một lượng dư H2SO4 đặc vào bình (nhiệt độ lúc này trong bình là t0C) đến khi áp suất ổn định thì thấy áp suất trong bình lúc này là P2 (P1= 1,75P2). Hiệu suất tổng hợp NH3 là:
A. 65%
B. 70%
C. 50%
D. 60%

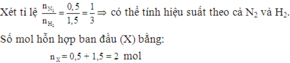
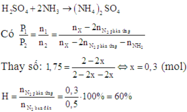
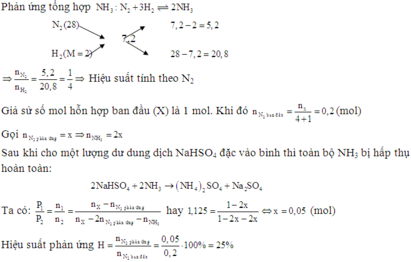


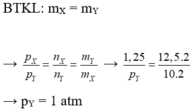



Đáp án D
Ta có số mol khí ban đầu là
n = 0,5 + 1,5 = 2 (mol)
Vì có n H 2 3 = n N 2 1 nên hiệu suất phản ứng tính theo N2 hoặc H2
Gọi x là số mol N2 phản ứng. Ta có:
N2 + 3H2 ⇌ 2NH3
x 3x 2x (mol)
Số mol N2 còn lại là: (0,5 - x) (mol)
Số mol H2 còn lại là: (1,5 - 3x) (mol)
Số mol NH3 sinh ra là: 2x (mol)
=> Số mol ở áp suất P1 là
n1 = (0,5 - x) + (1,5 - 3x) + 2x = (2 - 2x) (mol)
Áp dụng công thức n = PV/RT
Do phản ứng trong bình có thể tích V không đổi , sau phản ứng đưa về nhiệt độ t°C ban đầu nên:
P2/P1 = n2/n1 = số mol sau phản ứng / số mol trước phản ứng (*)
H2SO4 hấp thụ hoàn toàn NH3 theo PT:
2NH3+ H2SO4→ (NH4)2SO4
nên khí sau phản ứng chỉ có N2 và H2 với tổng số mol là:
n2 = (0,5 - x) + (1,5 - 3x) = 2 - 4x
Thay vào (*)
P2/P1 = (2 - 2x) / (0,2 - 4x)
=> P2 .(2 - 4x) = (2 - 2x)P1
Do P1=1,75P2
=> P2.(2 - 4x) = (2 - 2x).1,75P2
=> x = 0,3 (mol)
Hiệu suất phản ứng là:
H% = (0,3/0,5).100% = 60 %