Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
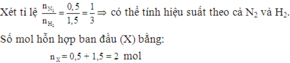
Gọi số mol N2 phản ứng là x mol ⇒ số mol NH3 là 2x mol.
Sau khi cho một lượng dư dung dịch H2SO4 đặc vào bình thì toàn bộ NH3 bị hấp thụ hoàn toàn:
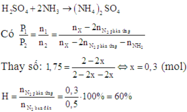

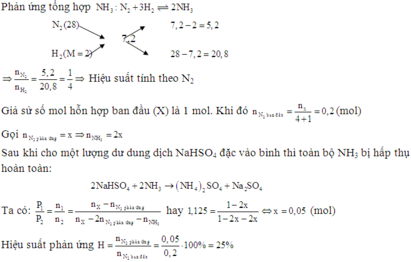
Đáp án C.
STUDY TIP: Việc đặt số mol hỗn hợp ban đầu bằng 1 mol giúp quá trình tính toán đơn giản hơn, do đó nó rất hiệu quả để giải nhanh các bài tập trắc nghiệm.

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất


Đáp án A
2NO+ O2 → 2NO2
Tổng số mol khí trước phản ứng là n1= 0,2+ 0,3= 0,5 mol
Ta có 0,2/2 < 0,3/1 nên NO phản ứng hết và O2 còn dư
2NO+ O2 → 2NO2
Trước pứ: 0,2 0,3 mol
Phản ứng: 0,2 0,1 0,2 mol
Sau pứ: 0 0,2 0,2 mol
Số mol khí sau phản ứng là n2= nO2+ nNO2= 0,4 mol
Do sau khi phản ứng đưa bình về nhiệt độ ban đầu nên tỉ lệ về áp suất chính là tỉ lệ về số mol.
Ta có P1/P2= n1/n2=0,5/0,4=1,25 → P1= 1,25P2

Đáp án D
Giả sử trộn 1 mol X và 15 mol Y → số mol O2 : 3 mol, số mol N2 : 12 mol
Gọi số mol của CO2 và H2O lần lượt 7x và 4x mol
Bảo toàn nguyên tố O → 7x. 2 + 4x = 3.2 → x = 1/3 mol
Vậy sau phản ứng trong bình chứa 7/3mol CO2 , 4/3 mol H2O và 12 mol N2
Có trong cùng điều kiện nhiệt độ thể tích thì


1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
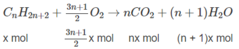
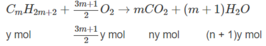
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
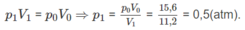
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
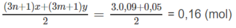
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
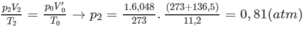
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 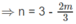
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.

Đáp án C
Các phản ứng xảy ra:
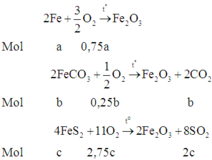
Vì áp suất trước và sau phản ứng không đổi nên số mol khí phản ứng bằng số mol khí sinh ra (tổng thể tích khí trong bình không thay đổi).
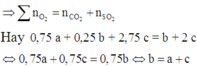
Đáp án D
Ta có số mol khí ban đầu là
n = 0,5 + 1,5 = 2 (mol)
Vì có n H 2 3 = n N 2 1 nên hiệu suất phản ứng tính theo N2 hoặc H2
Gọi x là số mol N2 phản ứng. Ta có:
N2 + 3H2 ⇌ 2NH3
x 3x 2x (mol)
Số mol N2 còn lại là: (0,5 - x) (mol)
Số mol H2 còn lại là: (1,5 - 3x) (mol)
Số mol NH3 sinh ra là: 2x (mol)
=> Số mol ở áp suất P1 là
n1 = (0,5 - x) + (1,5 - 3x) + 2x = (2 - 2x) (mol)
Áp dụng công thức n = PV/RT
Do phản ứng trong bình có thể tích V không đổi , sau phản ứng đưa về nhiệt độ t°C ban đầu nên:
P2/P1 = n2/n1 = số mol sau phản ứng / số mol trước phản ứng (*)
H2SO4 hấp thụ hoàn toàn NH3 theo PT:
2NH3+ H2SO4→ (NH4)2SO4
nên khí sau phản ứng chỉ có N2 và H2 với tổng số mol là:
n2 = (0,5 - x) + (1,5 - 3x) = 2 - 4x
Thay vào (*)
P2/P1 = (2 - 2x) / (0,2 - 4x)
=> P2 .(2 - 4x) = (2 - 2x)P1
Do P1=1,75P2
=> P2.(2 - 4x) = (2 - 2x).1,75P2
=> x = 0,3 (mol)
Hiệu suất phản ứng là:
H% = (0,3/0,5).100% = 60 %