Cho 5,85 gam muối NaX tác dụng với dd AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị 35X (x1%) và 37X (x2%). Vậy giá trị của x1% và x2% lần lượt là:
A. 25% & 75%
B. 75% & 25%
C. 65% & 35%
D. 35% & 65%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5(Cl)
ta có: ![]() = 35,5 => x = 75%
= 35,5 => x = 75%

Đáp án B
Khi cho NaX vào AgNO3 thu được kết tủa là AgX
Luôn có:
n NaX = n AgX ⇒ 5 , 85 23 + M X = 14 , 35 108 + M X ⇒ M X = 35 , 5
Ta có hệ
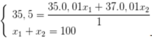
⇒


Đáp án B
Có phản ứng:
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:
n N a X = n A g X = 14 , 35 - 5 , 85 85 0 , 1 ( m o l )
⇒ M N a X = 5 , 85 0 , 1 = 58 , 5 ⇒ 23 + X = 58 , 5 ⇔ X = 35 , 5
⇒ x 1 + x 2 = 100 35 x 1 + 37 x 2 100 = 35 , 5 ⇔ x 1 = 75 x 2 = 25

Có phản ứng:
![]()
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:

Đáp án B

NaX+AgNO3-->AgX+NaNO3
theo pt ta có nNaX=nAgX
<=> 5,85/(23+X) =14,35/(108+X)
<=>5,85(108+X)=14,35(23+X)
<=>631,8+5,85X=330,05+14,35X
<=>8,5X=301,75
=>X=35,5(Cl)
ta có Atb của nguyên tố X là 35,5
(35X1+37X2)/100=35,5
=>X1=75% X2=25%

Đáp án A
• nCaX2 = nCa = 1,2 : 40 = 0,03 mol.
→ MCaX2 = 5,994 : 0,03 = 199,8 → MX = 79,9.
Phần trăm của X1 và X2 trong tự nhiên lần lượt là: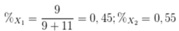
• Giả sử số nơtron trong X1 và X2 lần lượt là N1 và N2. Số proton trong X1 = X2 = Z
Ta có hpt:
![]()
→ Z + 0,1N2 = 39,4
Mà 1≤
N
Z
≤ 1,5
→ 1,1Z ≤ 39,4 và 1,15Z ≥ 39,4 → 34,26 ≤ Z ≤ 35,18 → Z = 35
→ N1 = 46; N2 = 44 → A1 = 46 + 35 = 81; A2 = 44 + 35 = 79

Đáp án : B
NaX + AgNO3 -> NaNO3 + AgX
x mol -> x mol
=> 2,06/(23 + X) = 3,76/(108 + X)
=> X = 80 (Br)
Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5 (Cl)
Ta có