Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5 (Cl)
Ta có ![]()

Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5(Cl)
ta có: ![]() = 35,5 => x = 75%
= 35,5 => x = 75%

Đáp án B
Khi cho NaX vào AgNO3 thu được kết tủa là AgX
Luôn có:
n NaX = n AgX ⇒ 5 , 85 23 + M X = 14 , 35 108 + M X ⇒ M X = 35 , 5
Ta có hệ
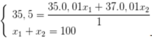
⇒


Đáp án B
Có phản ứng:
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:
n N a X = n A g X = 14 , 35 - 5 , 85 85 0 , 1 ( m o l )
⇒ M N a X = 5 , 85 0 , 1 = 58 , 5 ⇒ 23 + X = 58 , 5 ⇔ X = 35 , 5
⇒ x 1 + x 2 = 100 35 x 1 + 37 x 2 100 = 35 , 5 ⇔ x 1 = 75 x 2 = 25

Có phản ứng:
![]()
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:

Đáp án B

Đáp án D
Gọi phần trăm số nguyên tử của X 17 35 là x, X 17 37 là (100 – x).
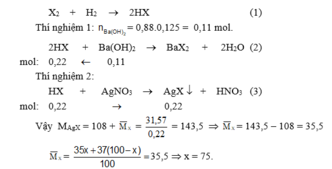
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : C 17 35 l (75% ) ; C 17 37 l (25%).

Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5
nAgX = 0,1, MAgX = 143,5 => X :35,5 (Cl)
Ta có

Zn+ 2HX --------> ZnX2 + H2
\(n_{ZnX_2}=n_{H_2}=0,175\left(mol\right)\)
\(M_{ZnX_2}=\dfrac{39,368}{0,175}=224,96\Rightarrow M_X=79,98\left(đvC\right)\)
Gọi x là % của đồng vị 81X2
\(\overline{X}=\dfrac{79\left(100-x\right)+81x}{100}=79,98\)
=> x=49
Ta có: \(n_{HX}=2n_{H_2}=0,35\left(mol\right)\)
=> \(n_{X_2}=0,35.49\%=0,1715\left(mol\right)\)
=> \(\%X_2=\dfrac{0,1715.81}{0,35.\left(1+79,98\right)}.100=49,01\%\)
=> Chọn A
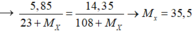
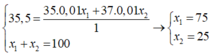
NaX+AgNO3-->AgX+NaNO3
theo pt ta có nNaX=nAgX
<=> 5,85/(23+X) =14,35/(108+X)
<=>5,85(108+X)=14,35(23+X)
<=>631,8+5,85X=330,05+14,35X
<=>8,5X=301,75
=>X=35,5(Cl)
ta có Atb của nguyên tố X là 35,5
(35X1+37X2)/100=35,5
=>X1=75% X2=25%
bạn ơi cho mình hỏi tại sao nNaX=nAgX v bạn ?