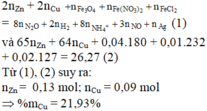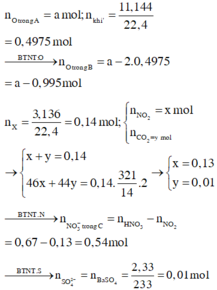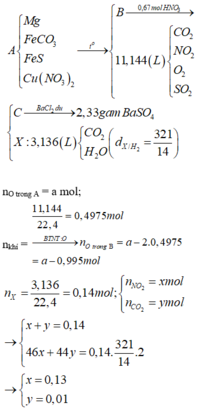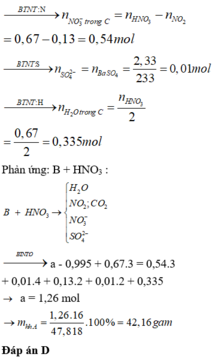Cho hỗn hợp X gồm 1,4 gam Fe và 1,6 gam Cu phản ứng hoàn toàn với một lượng khí C l 2 dư. Kết thúc phản ứng thấy thu được m gam muối. Tính m và thể tích khí C l 2 ở đktc cần dùng để phản ứng hết với lượng kim loại trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: \(Zn+Cl_2\underrightarrow{t^o}ZnCl_2\)
_____0,05-->0,05->0,05______(mol)
\(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
0,1--->0,15-->0,1_____________(mol)
=> m = \(0,05.136+0,1.133,5=20,15\left(g\right)\)
\(V_{Cl_2}=\left(0,05+0,15\right).22,4=4,48\left(l\right)\)
Một cách hơi khác nha ;-;
\(n_{Zn}=\dfrac{m}{M}=0,05\left(mol\right)n_{Al}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(Bte:2n_{Cl_2}=2n_{Zn}+3n_{Al}=0,4\)
\(\Rightarrow n_{Cl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=n.22,4=4,48\left(l\right)\)
Ta có : \(m_M=m_{KL}+m_{Cl}=3,25+2,7+0,2.71=20,15\left(g\right)\)
Vậy ..

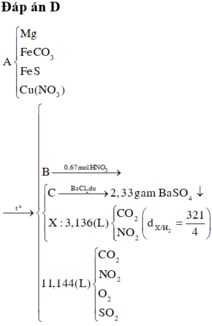
Đáp án : D
Xét X : có nX = 0,14 mol ; MX = 321/7g
Áp dụng qui tắc đường chéo => nCO2 = 0,01 mol ; nNO2 = 0,13 mol
Kết tủa 2,33g chính là BaSO4 => nBaSO4 = nSO2 = 0,01 mol
Khi khí B + HNO3 :
4NO2 + O2 + 2H2O -> 4HNO3
,x -> 0,25x
=> nB = nSO2 + nCO2 + nNO2 + nO2
=> 0,495 = 0,01 + 0,01 + 0,13 + x + 0,25x
=> x = 0,276 mol
Bảo toàn nguyên tố :
,nFeCO3 = nCO2 = 0,01 ; nCu(NO3)2 = ½nNO2 = 0,203 mol
=> nO(X) = 3nFeCO3 + 6nCu(NO3)2 = 1,248 mol
Vì %mO = 47,818% => m = 41,76g

Đáp án C
Nung M: 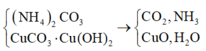
Chất rắn X lại phản ứng với HNO3 tạo NO2 nên X có Cu
Khí Y phản ứng với HC1 tạo muối nên Y có NH3
Mà ta thấy ở nhiệt độ cao thì 3CuO + 2NH3 3CuO + N2 + 3H2O
Do phản ứng xảy ra hoàn toàn nên NH3 dư, X chỉ có Cu. n NO 2 = 0 , 6


Đáp án D
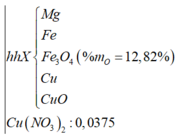
![]()
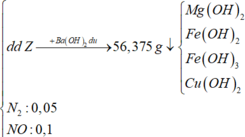
BTNT N: n NH 4 + = 2 n Cu ( NO 3 ) 2 + n KNO 3 + n NaNO 3 - 2 n N 2 - n NO = 0 , 025 mol
Gs: m KL ( X ) = m ' ; n O ( X ) = a
![]()
![]()
![]()
![]()
![]()
![]()
![]()