1.a) Cho 2,25 gam hỗn hợp A gồm Al, Fe, Cu tác dụng với dung dịch HCl dư, sau khi phản ứng kết thúc thu được 1344 ml (đktc) khí và còn lại 0,6 gam chất rắn không tan. Tính % khối lượng mỗi kim loại trong A.
b) Hấp thụ hoàn toàn 1,344 lít SO2 (đktc) vào 13,95 ml dung dịch KOH 28%, có khối lượng riêng là 1,147g/ml. Hãy tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng.
c) Lấy toàn bộ lượng HCl đã phản ứng ở trên trộn vào V lít dung dịch NaOH 0,2M được dung dịch B. Tính V, biết rằng lượng dung dịch B thu được có thể hòa tan hết 0,51 gam nhôm oxit.
2.Khi thêm 1 gam MgSO4 khan vào 100 gam dung dịch MgSO4 bão hoà ở 200C, thấy tách ra một tinh thể muối kết tinh trong đó có 1,58 gam MgSO4. Hãy xác định công thức của tinh thể muối ngậm nước kết tinh. Biết độ tan cuả MgSO4 ở 200C là 35,1 gam trong 100 gam nước.
P/s:Giúp mình-Yêu nhìuuu





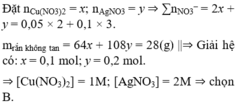

1. a) đặt nAl = a; nFe = b; nCu = c (mol); nH2 = 0,06 (mol)
PTHH:
2Al + 6HCl ---> 2AlCl3 + 3H2 (1)
mol: a 1,5a
Fe +2HCl ---> FeCl2 + H2 (2)
mol: b b
Cu + HCl -x-> (ko phản ứng)
chất rắn ko phản ứng là Cu nên mCu = 0,6 (g)
=> mAl + mFe = 2,25 - 0,6 = 1,65 (g) => 27a + 56b = 1,65 (g) (*)
Từ pt (1) và (2) => 1,5a + b = nH2 = 0,06 (mol) (**)
Từ (*) và(**) => a = 0,03 (mol); b = 0,015 (mol)
=> mAl = 0,81 (g); mFe = 0,84 (g)