Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Do Y tác dụng AgNO3 sinh ra NO
⇒ trong Y có chứa H+ và NO3– hết.
4H+ + NO3– + 3e → NO + 2H2O
⇒ ở phản ứng đầu, nH+ = 0,4 – 0,02 × 4 = 0,32 mol.
⇒ nNO3– = 0,32 ÷ 4 = 0,08 mol
⇒ nFe(NO3)2 = 0,04 mol.
Đặt nFeCl2 = x mol; nCu = y mol.
mX = 127x + 64y + 0,04 × 180 = 23,76 gam.
Bảo toàn nguyên tố Clo :
nAgCl = 2x + 0,4 mol.
Bảo toàn nguyên tố Ag :
nAg = 0,58 – (2x + 0,4) = 0,18 – 2x mol.
Bảo toàn electron cả quá trình :
nFeCl2 + 2nCu + nFe(NO3)2 = nAg + 3/4nH+.
⇒ x + 2y + 0,04 = 0,18 – 2x + 3/4 × 0,4
⇒ giải: x = 0,08 mol; y = 0,1 mol.
⇒ nAg = 0,02 mol; nAgCl = 0,56 mol
⇒ m = 0,02 × 108 + 0,56 × 143,5
= 82,52 gam.
Cách khác:
nNO = nH+ ÷ 4 = 0,4 ÷ 4 = 0,1 mol.
Bảo toàn nguyên tố Nitơ:
nNO3– = 0,04 × 2 + 0,58 – 0,1 = 0,56 mol.
Bảo toàn nguyên tố Fe:
nFe3+ = x + 0,04 mol.
Bảo toàn điện tích:
(x + 0,04) × 3 + 2y = 0,56 mol ⇒ x và y
⇒ giải tương tự như cách trên!

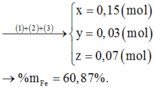
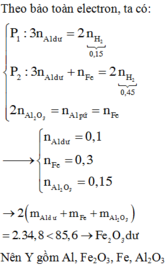
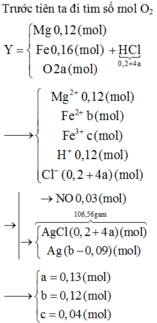
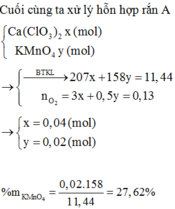

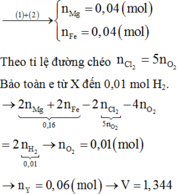
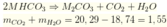


Ta có: $n_{Al}=n_{Fe}=0,1(mol)$
Sau phản ứng thì Al hết, Fe chưa phản ứng hoặc còn dư
Gọi số mol $Cu(NO_3)_2 và $AgNO_3$ lần lượt là a;b
Ta có: $64a+108b=28$
Bảo toàn e toàn bộ quá trình ta có: $2a+b=0,4$
Giải hệ ta được $a=0,1;b=0,2$
$\Rightarrow [Cu(NO_3)_2]=1M;[AgNO_3]=2M$
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0.05\left(mol\right)\)
\(n_{Al}=n_{Fe}=a\left(mol\right)\)
\(\Rightarrow a=\dfrac{8.3}{27+56}=0.1\)
\(n_{AgNO_3}=x\left(mol\right),n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\)
\(m_{cr}=108x+64y=28\left(1\right)\)
Bảo toàn e :
\(x+2y=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
\(C_{M_{AgNO_3}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0.1}{0.1}=1\left(M\right)\)