Hỗn hợp A chứa Fe và kim loại M (có hóa trị không đổi). Tỉ lệ số mol của M và Fe trong A là 2:3. Chia A thành 3 phần đều nhau.
- Phần 1: Đốt cháy hết trong khí oxi thu được 66,8g hỗn hợp gồm 2 oxit
- Phần 2: Hòa tan hết trong dung dịch HCl thu được 26,88lit H2 (dktc)
- Phần 3: Tác dụng vừa đủ với 33,6lit Cl2 (đktc)
Xác định tên kim loại M và khối lượng của từng kim loại trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì tỉ lệ số mol của M và Fe trong A là 2:3.
=> Gọi số mol là 2a mol M và 3a mol Fe
Gọi hóa trị của kim loại M là n
Phần 1:
3Fe + 2O2 → Fe3O4
3a------------------->a
4M + 3O2 → 2M2O3
2a------------------->a
Phần 2:
Fe + 2HCl → FeCl2 + H2
3a ------------------------------->3a
M + nHCl → MCln + \(\dfrac{n}{2}\)H2
2a -----------------------> a.n
=> 3a + a.n = \(\dfrac{26,88}{22,4}\) = 1,2 (*)
Phần 3:
2Fe + 3Cl2 → 2FeCl3
3a ----> \(\dfrac{9}{2}\)a
2M + nCl2 → 2MCln
2a -----> n.a
=> \(\dfrac{9}{2}\)a + n.a = \(\dfrac{33,6}{22,4}\) = 1,5 (**)
Từ (*) và (**) => a = 0,2 và n = 3
Ta có : 0,2.232 + 0,2(2M + 16.3) = 66,8
=> M = 27 (g/mol)
=> Kim loại M là nhôm (Al)
=> m Al ban đầu = 0,4.27.3= 32,4 (g)
mFe ban đầu = 0,6.56.3 = 100,8 (g)

Gọi số mol Fe và R trong 3 phần lần lượt là 3x và 2x
Phần 2:
Fe + 2HCl → FeCl2 + H2
3x ---------------------------------> 3x
R + nHCl → RCln + \(\dfrac{n}{2}\)H2
2x -----------------------------> x.n
=> 3x + x.n = 26,88:22,4 = 1,2 (1)
Phần 3:
2Fe + 3Cl2 → 2FeCl3
3x ----> 4,5x
2R + nCl2 → 2RCln
2x -----> n.x
=> 4,5x + n.x = 33,6:22,4 = 1,5 (2)
Từ (1) và (2) => \(\left\{{}\begin{matrix}3x+n.x=1,2\\4,5x+n.x=1,5\end{matrix}\right.\)=> x = 0,2 và n = 3
Phần 1:
3Fe + 2O2 → Fe3O4
3x ------------------->x
4R + 3O2 → 2R2O3
2x-------------------->x
x.232 + x(2R + 16.3) = 66,8 với x = 0,2 => R = 27 (g/mol)
=> Kim loại R là nhôm (Al) và mFe = 0,6.56.3 = 100,8 gam và mAl = 0,4.27.3 = 32,4 gam

gọi hóa trị của M là n
p2:
Fe--> Fe+2 + 2e
x------------------>2x
M--> M+n + ne
y----------------->yn
2x+ yn= 1,2*2
P3
Fe--> Fe+3 + 3e
M--> M+n + ne
3x+ yn= 1,5*2
--> x=0,6, y=0,4
--> n=3--> ox M là M2O3
mM2O3=66,8- 232*0,2= 20,4
--> M(M2O3)=102--> M=27: Al
mFe=100,8
mAl=32,4

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 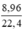 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 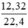 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
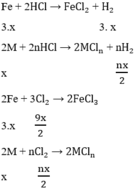
Theo bài ra ta có hệ phương trình:
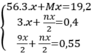
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
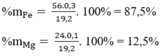

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 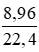
Số mol Cl2 là: nCl2 = 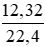
Các PTHH
Theo bài ra ta có hệ phương trình:
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 =
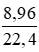 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 =
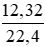 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
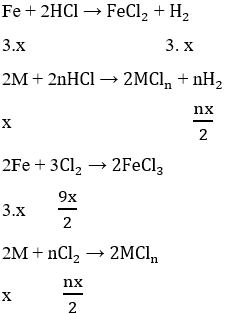
Theo bài ra ta có hệ phương trình:
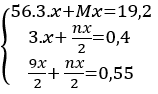
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng


đề cho có bị sai số liệu không?
Thể tích khí Cl2 sao lại là 13,32(l) ????
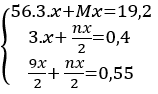
Mỗi phần có 2a mol M, 3a mol Fe
- P2: \(n_{Cl}=n_{HCl}=2n_{H2}=2,4\left(mol\right)\)
- P3:\(n_{Cl}=2n_{Cl2}=3\left(mol\right)\)
\(FeCl_2+Cl\rightarrow FeCl_3\)
Lượng Cl tăng lên của P3 so với P2:
\(3-2,4=0,6\left(mol\right)=n_{FeCl2}=n_{Fe}\)
\(\Rightarrow3a=0,6\)
\(\Rightarrow a=0,2\Rightarrow n_M=0,4\left(mol\right)\)
- P1: Thu đc 2 oxit M2Ox (0,2 mol) và Fe3O4 (0,2 mol)
\(\Rightarrow\left(2M+16x\right).0,2+232.0,2=66,8\)
\(\Rightarrow2M+16x=102\)
\(x=3\Rightarrow M=27\)
Vậy M là Al
\(\%m_{Al}=\frac{0,4.27.100}{0,4.27+0,6.56}=24,32\%\)
\(\%m_{Fe}=100\%-24,32\%=75,68\%\)