Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì tỉ lệ số mol của M và Fe trong A là 2:3.
=> Gọi số mol là 2a mol M và 3a mol Fe
Gọi hóa trị của kim loại M là n
Phần 1:
3Fe + 2O2 → Fe3O4
3a------------------->a
4M + 3O2 → 2M2O3
2a------------------->a
Phần 2:
Fe + 2HCl → FeCl2 + H2
3a ------------------------------->3a
M + nHCl → MCln + \(\dfrac{n}{2}\)H2
2a -----------------------> a.n
=> 3a + a.n = \(\dfrac{26,88}{22,4}\) = 1,2 (*)
Phần 3:
2Fe + 3Cl2 → 2FeCl3
3a ----> \(\dfrac{9}{2}\)a
2M + nCl2 → 2MCln
2a -----> n.a
=> \(\dfrac{9}{2}\)a + n.a = \(\dfrac{33,6}{22,4}\) = 1,5 (**)
Từ (*) và (**) => a = 0,2 và n = 3
Ta có : 0,2.232 + 0,2(2M + 16.3) = 66,8
=> M = 27 (g/mol)
=> Kim loại M là nhôm (Al)
=> m Al ban đầu = 0,4.27.3= 32,4 (g)
mFe ban đầu = 0,6.56.3 = 100,8 (g)

gọi hóa trị của M là n
p2:
Fe--> Fe+2 + 2e
x------------------>2x
M--> M+n + ne
y----------------->yn
2x+ yn= 1,2*2
P3
Fe--> Fe+3 + 3e
M--> M+n + ne
3x+ yn= 1,5*2
--> x=0,6, y=0,4
--> n=3--> ox M là M2O3
mM2O3=66,8- 232*0,2= 20,4
--> M(M2O3)=102--> M=27: Al
mFe=100,8
mAl=32,4

Gọi hóa trị của R là n
Số mol của Fe, R trong từng phần là 3a, 2a
Phần 2:
Ta có :
\(\text{nH2 = 26,88 : 22,4 = 1,2 mol}\)
\(\text{Fe + 2HCl → FeCl2 + H2↑}\)
3a......................................3a.......(mol)
\(\text{2R + 2nHCl → 2RCln + nH2↑}\)
2a............................................na.............(mol)
\(\text{nH2 = 3a + na = 1,2 mol (1)}\)
Phần 3:
\(\text{nCl2 = 33,6 : 22,4 = 1,5 mol}\)
\(\text{2Fe + 3Cl2 → 2FeCl3}\)
3a.........4,5a.......................(mol)
\(\text{2R + nCl2 → 2RCln }\)
2a.........an.....................(mol)
\(\text{nCl2 = 4,5a + an = 1,5 mol (2)}\)
Từ (1) và (2) → a = 0,2; an = 0,6
→ n = 3
Phần 1:
\(\text{nFe = 0,6mol; nR = 0,4 mol}\)
\(\text{3Fe + 2O2 → Fe3O4}\)
0,6.......................0,2.............(mol)
\(\text{4R + 3O2 → 2R2O3}\)
0,4...................0,2..................(mol)
\(\text{mFe3O4 + mR2O3 = 66,8}\)
→ 0,2 . 232 + 0,2 . (2.MR + 48) = 66,8
→ MR = 27
→ R là nhôm
Trong hỗn hợp A có:
\(\text{mFe = 0,6 . 56 . 3 = 100,8(g)}\)
\(\text{mAl = 0,4 . 27 . 3 = 32,4(g)}\)

Câu 1
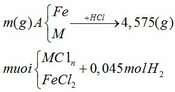
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
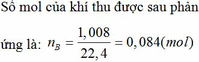
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
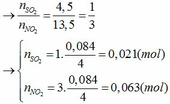
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
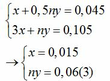
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi x,y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=11\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=>\(\%m_{Fe}=\dfrac{0,1.56}{11}.100=50,91\%\)
=> %m Al = 100 - 50,91 =49,09 %
b)Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c) \(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{0,2}{2}}{0,2}=0,5M\)
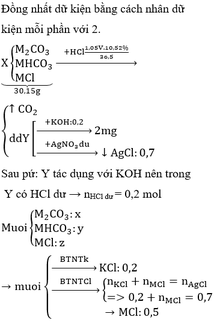
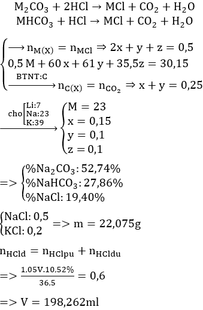


Mỗi phần có 2a mol M, 3a mol Fe
- P2: \(n_{Cl}=n_{HCl}=2n_{H2}=2,4\left(mol\right)\)
- P3:\(n_{Cl}=2n_{Cl2}=3\left(mol\right)\)
\(FeCl_2+Cl\rightarrow FeCl_3\)
Lượng Cl tăng lên của P3 so với P2:
\(3-2,4=0,6\left(mol\right)=n_{FeCl2}=n_{Fe}\)
\(\Rightarrow3a=0,6\)
\(\Rightarrow a=0,2\Rightarrow n_M=0,4\left(mol\right)\)
- P1: Thu đc 2 oxit M2Ox (0,2 mol) và Fe3O4 (0,2 mol)
\(\Rightarrow\left(2M+16x\right).0,2+232.0,2=66,8\)
\(\Rightarrow2M+16x=102\)
\(x=3\Rightarrow M=27\)
Vậy M là Al
\(\%m_{Al}=\frac{0,4.27.100}{0,4.27+0,6.56}=24,32\%\)
\(\%m_{Fe}=100\%-24,32\%=75,68\%\)