Trộn đều 2g MnO2 và 98g hỗn hợp KCl và KClO3 rồi đem đun nóng đến khi phản ứng xảy ra hoàn toàn thì thu được hỗn hợp chất rắn nặng 76g. Xác định khối lượng muối trong hỗn hợp ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng oxi thoát ra: m O 2 = 197 + 3 – 152 = 48(g)
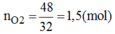
PTHH của phản ứng:
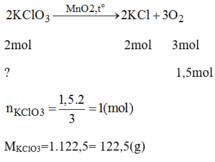
Khối lượng của KCl trong hỗn hợp ban đầu:
m K C l = 197-122,5 = 74,5(g)
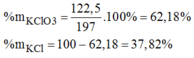

mgiảm = mO2 (sinh ra) = 200 + 3 - 145,4 = 57,6 (g)
\(\rightarrow n_{O_2}=\dfrac{57,6}{32}=1,8\left(mol\right)\)
PTHH: 2KClO3 --to, MnO2--> 2KCl + 3O2
1,2 1,8
\(\rightarrow m_{KClO_3}=1,2.122,5=147\left(g\right)\\ \rightarrow\left\{{}\begin{matrix}\%m_{KClO_3}=\dfrac{147}{200}=73,5\%\\\%m_{KCl}=100\%-73,5\%=26,5\%\end{matrix}\right.\)
Khối lượng oxi thoát ra: 197 + 3 – 152 = 48(g)
Số mol O2=4832=1,5(mol)O2=4832=1,5(mol)
Phương trình hóa học của phản ứng :
2KClO3MnO2,to⟶2KCl+3O22KClO3⟶MnO2,to2KCl+3O2
2 mol 3 mol
1,5×23=1mol1,5×23=1mol ←← 1,5 mol
Khối lượng KClO3KClO3 trong hỗn hợp : 1 x 122,5 =122,5 (g)Khối lượng KCl trong hỗn hợp ban đầu: 197 – 122,5 = 74,5(g)→%mKClO3=62,18%;%mKCl=37,82%→%mKClO3=62,18%;%mKCl=37,82%

Đáp án A.
Bảo toàn khối lượng: mO2 = 3 + 197 – 152 = 48 (gam)
nO2 = 1,5 (mol)
2KClO3 → 2KCl + 3O2 ↑
⇒ mKCl = 197 – 1.122,5 = 74,5 (gam)

Đáp án C
MnO2 là chất xúc tác nên sử dụng định luật bảo toàn khối lượng ta được:
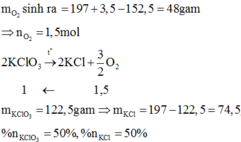

pt: 2KClO3---MnO2/t*--->2KCl+3O2
mO2=197+3-152=48(g)
=>nO2=48/32=1,5(mol)
Theo pt: nKClO3=2/3nO2=2/3.1,5=1(mol)
=>mKClO3=1.122,5=122,5(g)
=>%mKClO3=122,5/197.100~62,18%
=>%mKCl=100%-62,18%=37,82%

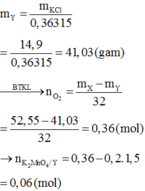
Sau phản ứng thu được: \(76-2=74gKCl\)
\(\Rightarrow n_{KCls.p.ứ}=\frac{74}{74,5}=1mol\)
Gọi \(x\) là mol \(KCl;y\) là mol \(KClO_3\) ban đầu.
\(\Rightarrow74,5x+122,5y=98\left(1\right)\)
\(PTHH:2KClO_3\overset{t^0}{\rightarrow}2KCl+3O_2\)
\(\Rightarrow n_{KCl.nung}=y\)
\(\Rightarrow x+y=1\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow x=y=0,5\)
\(m_{KCl}=0,5.74,5=37,25g\)
\(m_{KClO_3}=0,5.122,5=61,25g\)