Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng oxi thoát ra: m O 2 = 197 + 3 – 152 = 48(g)
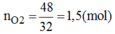
PTHH của phản ứng:
Khối lượng của KCl trong hỗn hợp ban đầu:
m K C l = 197-122,5 = 74,5(g)
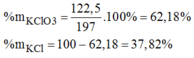

pt: 2KClO3---MnO2/t*--->2KCl+3O2
mO2=197+3-152=48(g)
=>nO2=48/32=1,5(mol)
Theo pt: nKClO3=2/3nO2=2/3.1,5=1(mol)
=>mKClO3=1.122,5=122,5(g)
=>%mKClO3=122,5/197.100~62,18%
=>%mKCl=100%-62,18%=37,82%

Do khối lượng chất rắn trong X và Y bằng nhau
=> Lượng O2 sinh ra khi phân hủy KClO3 phản ứng hết với Cu
PTHH: 2KClO3 --to--> 2KCl + 3O2
a--------------->1,5a
2Cu + O2 --to--> 2CuO
3a<--1,5a
=> b \(\ge\) 3a

Gọi 2x, y lần lượt là số mol của KClO3, KCl
\(2KClO_3-t^0->2KCl+3O2\)
2x.............................2x...............3x
\(\left[{}\begin{matrix}74,5.\left(2x+y\right)=35,6-2\\74,5y+245x=48\end{matrix}\right.\)
\(\Leftrightarrow\left[{}\begin{matrix}x=0,15\\y=0,15\end{matrix}\right.\)
\(m_{KCl}=0,15.74,5=11,175\left(g\right)\)
\(m_{KClO_3}=0,15.2.122,5=36,75\left(g\right)\)
\(\%KCl_{tt}=\dfrac{0,15.2.74,5}{74,5}.100\%=46,5625\%\)
\(\%KCl=100\%-46,5625\%=53,4375\%\)
t k chăc lắm có j sai thì mn sửa hộ :)
Trộn đều 2g MnO2 và 98g hỗn hợp X gồm KClO3 và KCl rồi đun nóng đến khi phản ứng xảy ra hoàn toàn thì thu được chất rắn cân nặng 76g. Xác định khối lượng mỗi muối trong hỗn hợp X.
#giải #dùm #mình #với #gấp #lắm #ạ

Vì Mn02 là chất xúc tác cho nên chất rắn còn lại
gồm KCl và Mn02
=>mKCl=152-3=149(g)
Gọi x là số mol KCl03 ,y là số mol KCl tạo thành:
122.5x+74.5y=197 74.5x+74.5y=149
<=>x=y=1
=>mKCl03=1*122.5=122.5(g)
=>%KCl03=122.5*100%/197=62.18%
=>%KCl=100%-62.18%=37.82%
C2:Vì khối lượng còn lại giảm so với ban đầu do oxi thoát ra ngoài
=>m02=197+3-152=48(g)
=>n02=48/32=1.5mol
=>nKCl03=1.5*2/3=1mol
=>%KCl03=(1*122.5)*100%/197=62.18%
=>%KCl=100%-62.18%=37.82%

Các PTHH của phản ứng:
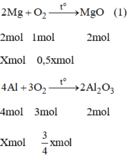
Khối lượng tăng bằng khối lượng của oxi tham gia phản ứng ⇒ m O 2 = 2g.
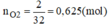
Vì Mg và Al có số mol bằng nhau. Gọi n M g = n A l = x mol
Từ phương trình (1) và (2) ta có:
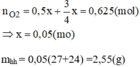
Sau phản ứng thu được: \(76-2=74gKCl\)
\(\Rightarrow n_{KCls.p.ứ}=\frac{74}{74,5}=1mol\)
Gọi \(x\) là mol \(KCl;y\) là mol \(KClO_3\) ban đầu.
\(\Rightarrow74,5x+122,5y=98\left(1\right)\)
\(PTHH:2KClO_3\overset{t^0}{\rightarrow}2KCl+3O_2\)
\(\Rightarrow n_{KCl.nung}=y\)
\(\Rightarrow x+y=1\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow x=y=0,5\)
\(m_{KCl}=0,5.74,5=37,25g\)
\(m_{KClO_3}=0,5.122,5=61,25g\)