Một dung dịch X có chứa 0,01 mol B a 2 + Ba2+ ; 0,01 mol N O 3 − NO3− ; a mol O H − OH− và b mol N a + Na+ . Để trung hoà một nửa dung dịch X người ta cần dùng 200 ml dung dịch HCl 0,1M. Khối lượng chất rắn thu được khi cô cạn dung dịch X là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Theo ĐLBT ĐT thì: 0,01.2+ b = 0,01+a
H+ + OH- → H2O
nOH-= nH+= 0,04 mol = a suy ra b = 0,03 mol
Khối lượng chất rắn thu được khi cô cạn dung dịch X là:
0,01.137+ 0,01.62+ 17.0,04+ 23.0,03 = 3,36 gam

Đáp án B
Lời giải chi tiết
Để trung hòa ½ dung dịch X cần 0,02 mol HCl nên số mol OH- trong X là 0,04 mol hay a=0,04
Bảo toàn điện tích: b = 0,04 + 0,01 - 0,01.2 = 0,03
=> m = 0,01.137 + 0,01.62 + 0,04.17 + 0,03.23 = 3,36 gam

Đáp án B
Để trung hòa ½ dung dịch X cần 0,02 mol HCl nên số mol OH- trong X là 0,04 mol hay a=0,04
Bảo toàn điện tích: b= 0,04+0,01-0,01.2= 0,03
=> m= 0,01.137+0,01.62+0,04.17+0,03.23= 3,36 gam

Đáp án B
Theo ĐLBT ĐT có: 0,01.2+ b = 0,01 +a
OH-+ H+ → H2O
nOH-= a = 0,2.0,1.2 = 0,04 mol nên b = 0,03 mol
mchất rắn = 0,01.137+ 0,01.62+ 0,04.17+ 0,03.23 = 3,36 gam

Đáp án A
a = nOH- = nH+ = 0,1.0,4 = 0,04 mol
BTĐT: 2nBa2+ + nNa+ = nNO3- + nOH- => 2.0,01 + b = 0,01 + 0,04 => b= 0,03
m chất rắn = 0,01.137+0,01.62+0,04.17+0,03.23=3,36 gam

Đáp án C
Số mol nHCl = 0,04 mol ⇒ nOH– = 0,04 mol.
⇒ Bảo toàn điện tích ta có: nNa+ = 0,03 mol.
⇒ Chất rắn thu được khi cô cạn dd X = 0,01×137 + 0,01×62 + 0,04×17 + 0,03×23 = 3,36 gam.

Đáp án C
Số mol nHCl = 0,04 mol ⇒ nOH– = 0,04 mo.
⇒ Bảo toàn điện tích ta có: nNa+ = 0,03 mol.
⇒ Chất rắn thu được khi cô cạn dd X = 0,01×137 + 0,01×62 + 0,04×17 + 0,03×23 = 3,36 gam
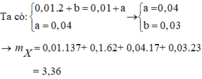


Để trung hòa nửa dung dịch X cần 200ml dd HCl 0,1M
→ Để trung hòa dung dịch X cần 200 . 2 = 400ml dd HCl 0,1M
nHCl cần để trung hòa\(\text{ X = 0,4 . 0,1 = 0,04 mol}\)
nH+ = nHCl = 0,04 mol
H+ + OH- → H2O
0,04→0,04
ADĐLBT điện tích: 2 . nBa2+ + nNa+ = nNO3- + nOH-
→ nNa+ = 0\(\text{,01 + 0,04 - 0,01 . 2 = 0,03 mol}\)
Cô cạn X:
mcr = mBa2+ + mNO3- + mOH- + mNa+
\(\text{= 0,01 . 137 + 0,01 . 62 + 0,04 . 17 + 0,03 . 23}\)
\(\text{ = 3,36 (g)}\)