7/ Cho 2,76g một kim loại kiếm M tác dụng với nước thu được 1,344 lít khí( đktc)
a) Xác định tên KL kiềm
b) X là 1 halogen. Cho 7,1g halogen này tác dụng với KL kiềm M trên thu đc 11,7g muối. Tìm tên halogen
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(M+2H_2O\rightarrow M\left(OH\right)_2+H_2\)
\(0.2........................................0.2\)
\(M_M=\dfrac{8}{0.2}=40\left(\dfrac{g}{mol}\right)\)
\(M:Ca\left(Canxi\right)\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: A + 2H2O --> A(OH)2 + H2
_____0,2<--------------------------0,2
=> \(M_A=\dfrac{8}{0,2}=40\left(g/mol\right)=>Ca\)

\(\text{Đ}\text{ặt}:A\\ A+HCl\rightarrow ACl+H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_A=n_{ACl_2}=2.n_{H_2}=0,1.2=0,2\left(mol\right)\\ M_{ACl}=\dfrac{11,7}{0,2}=58,5\left(\dfrac{g}{mol}\right)\\ M\text{à}:M_{ACl}=M_A+35,5\\ \Rightarrow M_A=23\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Natri\left(Na\right)\\ a=23.0,2=4,6\left(g\right)\)
nH2=2,24/22,4=0,1(mol)
2M+2HCl→2MCl+H2
0,2 ← 0,2 ← 0,1
Có 0,2 .(M+35,5)=11,7(gam)
⇒ M=23 ⇒M là Na
mNa=23. 0,2= 4,6 (gam)

Gọi công thức chung cho hai kim loại kiềm là M
Số mol H2: nH2 = 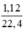 = 0,05(mol)
= 0,05(mol)
PTHH: 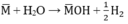
Theo pt: nM = 2. nH2 = 2. 0,05 = 0,1(mol)
⇒ M = 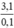 = 31 → Na, K
= 31 → Na, K
Gọi x, y lần lượt là số mol của Na và K trong hỗn hợp
Theo bài ra ta có hệ phương trình:
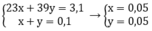
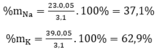

Gọi kim loại kiềm là R
PTHH: 2R + 2xH2O ---> 2R(OH)x + xH2
Ta có: \(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{x}.n_{H_2}=\dfrac{2}{x}.0,03=\dfrac{0,06}{x}\left(mol\right)\)
=> \(M_R=\dfrac{1,38}{\dfrac{0,06}{x}}=\dfrac{1,38x}{0,06}=23x\left(g\right)\)
Biện luận:
| x | 1 | 2 | 3 |
| M | 23 | 46 | 69 |
| Na | loại | loại |
Vậy kim loại kiềm là natri (Na)
Gọi kim loại kiềm cần tìm là M. (kim loại kiềm có hóa trị l)
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03mol\)
\(2M+H_2O\rightarrow M_2O+H_2\)
0,06 0,03
\(\Rightarrow n_M=\dfrac{1,38}{\overline{M_M}}=0,06\) \(\Rightarrow\overline{M_M}=23\left(Na\right)\)
Vậy kim loại M cần tìm là Natri(Na).

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2X + 2nH2O → 2XOHn + nH2
Mol: \(\dfrac{0,5}{n}\) 0,25
\(\Rightarrow M_X=\dfrac{10}{\dfrac{0,5}{n}}=20n\left(g/mol\right)\)
Vì X là kim loại nên có hóa trị l,ll,lll
| n | l | ll | lll |
| Mx | 20 | 40 | 60 |
| Kết luận | loại | thỏa mãn | loại |
⇒ X là canxi (Ca)

\(n_{H_2}=\dfrac{v}{22,4}=\dfrac{11,2}{22,4}=0,05mol\)
-Gọi A là kim loại kiềm
2A+2H2O\(\rightarrow\)2AOH+H2
\(n_A=2n_{H_2}=2.0,05=0,1mol\)
\(M_A=\dfrac{m_A}{n_A}=\dfrac{3,9}{0,1}=39\left(K\right)\)
\(n_{KOH}=n_K=0,1mol\rightarrow m_{KOH}=0,1.56=5,6gam\)
\(m_{dd}=m_K+m_{H_2O}-m_{H_2}=3,9+500-0,05.2=503,8gam\)
C%KOH=\(\dfrac{5,6.100}{503,8}\approx\)1,11%
-Gọi X là kim loại kiềm cần tìm
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
PTHH: \(2X+2H_2O\rightarrow2XOH+H_2\)
=> 0,1mol 0,1mol 0,05mol
\(M_X=\dfrac{m}{n}=\dfrac{3,9}{0,1}=39\)
Vậy kim loại X cần tìm là Kali (K)
Ta có: \(m_{KOH}=0,1.\left(39+16+1\right)=5,9\left(g\right)\)
\(m_{ddKOH}=m_K+m_{H_2O}-m_{H_2}=3,9+500-\left(0,05.2\right)=503,8\left(g\right)\)
\(C\%=\dfrac{m_{KOH}}{m_{ddKOH}}.100\%=\dfrac{5,9}{503,8}.100\%\approx1,17\%\)
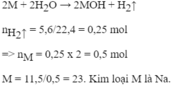

\(\text{a)2M+2H2O}\rightarrow\text{2MOH+H2}\)
Ta có :
\(n_{H2}=\frac{1,334}{22,4}=\text{0,06(mol)}\)
\(\rightarrow\text{nM=0,06.2=0,12(mol)}\)
\(M_M=\frac{2,76}{0,12}=23\)
\(\rightarrow\)M là Natri
\(\text{b) 2Na+X2}\rightarrow\text{2NaX}\)
Ta có
mNa=mNaX-mX2=11,7-7,1=4,6(g)
\(n_{Na}=\frac{4,6}{23}\text{=0,2(mol)}\)
\(\rightarrow n_{X2}=\frac{0,2}{2}=\text{0,1(mol)}\)
\(\rightarrow M_{X2}=\frac{7,1}{0,1}=\text{71}\)
\(\rightarrow\text{MX=35,5}\)
Vậy X là Clo