Cho 16,9 gam hỗn hợp như trên vào 2 lít dd HCl 0,75M, phản ứng xong thu được dd X. Cho 2 lít dd KOH vào X kết thúc phản ứng thì thu được 7,8 gam kết tủa. Xác định nồng độ mol/lít của dd KOH đã dùng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
+) ½ X + BaCl2:
Ba 2 + + CO 3 2 - → BaCO 3 ↓ 0 , 06 0 , 06
+) ½ X + CaCl2:
2 HCO 3 - → CO 2 ↑ + H 2 O + CO 3 2 - x 2 0 , 25 x Ca 2 + + CO 3 2 - → CaCO 3 ↓ ( 0 , 25 x + 0 , 06 ) → ( 0 , 25 x + 0 , 06 ) = 0 , 07 HCO 3 - + OH - → CO 3 2 - + H 2 O 0 , 12 ← 0 , 12 ← 0 , 12
⇒ tổng nHCO3- = 0,12 + 0,04 = 0,06 mol
⇒ a = 0,08 mol/l
⇒ m = 40.0,12 = 4,8 g

Đáp án A
Lấy 1 lít dd X t/d với dd BaCl2 (dư) thu được:
nBaCO3 = n CO32- = 11,82 : 197 = 0,06mol
⇒ nCO32-/X = nBaCO3 = 0,06×2 = 0,12
Mặt khác, cho 1 lít dd X vào dd CaCl2 (dư) rồi đun nóng, sau khi kết thúc các pư thu được:
n CaCO3 = n CO32- = 0,07
⇒ Lượng CO32- tạo ra từ HCO3- đun nóng = 0,07 – 0,06 = 0,01
2HCO3- → CO32- + H2O + CO2
0,02 ← 0,01 (mol)
⇒ nHCO3-/X = 2.0,02 =0,04
Bảo toàn C: ⇒ nNaHCO3 = nHCO3- ban đầu = nCO32-/X + nHCO3-/X = 0,16
⇒ a = 0,08

nKOH : nNaOH = 1,25 : 0,75 = 5 : 3
=> Gộp 2 kiềm thành ROH (2V mol) với R = \(\dfrac{39,5+23,3}{8}\) = 33
nP2O5 = 0,05 =>; nH3PO4 = 0,1
+ Nếu sản phẩm là RH2PO4 (0,1 mol)
=> mRH2PO4 = 13
Nếu sản phẩm là R2HPO4 (0,1 mol)
=> mR2HPO4 = 16,2
+ Nếu sản phẩm là R3PO4 (0,1 mol)
=>mR3PO4 = 19,4
Theo đề thì m rắn = 24,4 > 19,4
=>Chất rắn gồm R3PO4 (0,1 mol) và ROH dư
->nROH dư = 0,1
Bảo toàn R
->nROH = 2V = 0,4
=>V = 0,2 lít = 200 ml.

Đặt a, b, c là số mol Mg, Al, Fe
-> mA = 24a + 27b + 56c = 4,3
Với NaOH =>; nH2 = 1,5b = 0,075
Với HCl =>; nH2 = a + 1,5b + c = 0,135
=>a = 0,01; b = 0,05; c = 0,05
=> A gồm Mg (5,47%), Al (30,75%) và Fe (63,78%)
Al(OH)3 tan trong NaOH dư nên chất rắn còn lại gồm MgO (a) và Fe2O3 (0,5c)
=> m rắn = 4,4 gam
Dễ thấy b = c = 5a nên trong x gam A chứa Mg (y), Al (5y) và Fe (5y)
Bảo toàn electron: 2y + 3.5y + 2.5y = 0,6.3
=>y = 1/15
=>x = 439/15 gam

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,3\left(mol\right)=n_{ZnCl_2}\\n_{HCl}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0.3\cdot65}{35,5}\cdot100\%\approx54,93\%\\\%m_{Cu}=45,07\%\\C\%_{HCl}=\dfrac{0,6\cdot36,5}{500}\cdot100\%=4,38\%\\m_{ZnCl_2}=0,3\cdot136=40,8\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{Cu}=35,5-0,3\cdot65=16\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{KL}+m_{ddHCl}-m_{Cu}-m_{H_2}=518,9\left(g\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{40,8}{518,9}\cdot100\%\approx7,86\%\)
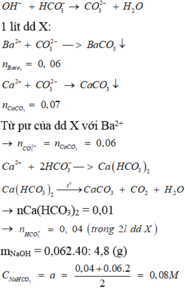

Cho 16,9 gam A ( Na = 0,5 mol; Al = 0,2 mol) vào dung dịch HCl
nHCl = 2. 0,75 = 1,5 (mol)
PTHH: 2Na + 2HCl 2NaCl + H2 (3)
2NaCl + H2 (3)
2Al + 6HCl 2AlCl3 + 3H2 (4)
2AlCl3 + 3H2 (4)
Vì nHCl = 1,5 > nNa + 3nAl = 1,1 (mol). Vậy HCl phản ứng dư.
Ta có : nHCl dư = 1,5 - 1,1 = 0,4 (mol)
Khi cho dung dịch KOH và dung dịch sau phản ứng vì có kết tủa HCl hết:
PTHH: KOH + HCl KCl + H2O ( 5)
KCl + H2O ( 5)
0,4 0,4
3KOH + AlCl3 Al(OH)3 + 3KCl (6)
Al(OH)3 + 3KCl (6)
3a a a
Có thể xảy ra : KOH + Al(OH)3 KAlO2 + H2O (7)
KAlO2 + H2O (7)
b b
Na + H2O -> NaOH + 0,5H2
Al + H2O + NaOH -> NaAlO2 + 1,5H2
Do H2O dư nên Na luôn tan hết. Để Al tan hết thì nAl \(\le\) nNaOH
-> nNA/nAl \(\ge\) 1