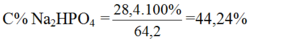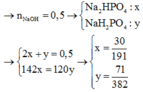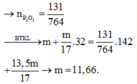đốt cháy hoàn toàn 6,2 gam Photpho rồi cho toàn bộ sản phẩm vào nước thu được 300ml dung dịch A ( có D= 1,2g/10l).
a)Tính nồng độ % và nồng độ mol dung dịch A
b)cho 9,2 gam Na vào dung dịch A. Tính nồng độ % dung dịch sau phản ứng
mong các bạn giúp mình với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 5:
Ta có: \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
a, PT: \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
_____0,2__0,25__0,1 (mol)
b, VO2 = 0,25.22,4 = 5,6 (l)
c, PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
______0,1______________0,2 (mol)
\(\Rightarrow m_{H_3PO_4}=0,2.98=19,6\left(g\right)\)
\(\Rightarrow C\%_{H_3PO_4}=\dfrac{19,6}{120}.100\%\approx16,33\text{ }\%\)
Bạn tham khảo nhé!

Đáp án B.
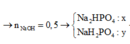
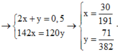
→ n P 2 O 5 = 131 764
→ B T K L m + m 17 . 32 → m = 11 , 66

Photpho cháy trong không khí lấy dư theo phản ứng :
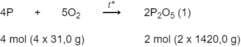
P 2 O 5 tác dụng với tạo thành H 3 P O 4 theo phản ứng :
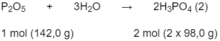
Theo phản ứng (1): 4 x 31,0 g P tạo ra 2 x 142,0 g P 2 O 5
a g P tạo ra 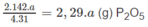
Theo các phản ứng (1) và (2) :
4 x 31,0 (g) P tạo ra 4 x 98,0 (g) H 3 P O 4
a (g) P tạo ra 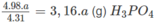
Khối lượng H 3 P O 4 có trong 500,0 ml dung dịch 85,00% :
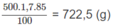
Khối lượng H 3 P O 4 sau khi đã hoà tan P 2 O 5 : 722,5 g + 3,16 x a g.
Khối lượng của dung dịch H 3 P O 4 sau khi đã hoà tan P 2 O 5 :
500,0 x 1,7 g + 2,29 x a g = 850,0 g + 2,29 x a g
Ta có phương trình về nồng độ phần trăm của dung dịch H 3 P O 4 :
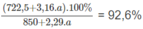
Giải phương trình được a = 62,16 g photpho.

Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2