Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

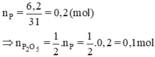
Theo pt: nNaOH = 4. nP2O5 = 4. 0,1 = 0,4 mol
Khối lượng NaOH = 0,4. 40 = 16 g
Khối lượng dung dịch NaOH = 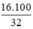 = 50,0 g
= 50,0 g

Phương trình phản ứng:
4P + 5O2 → 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)

a, (1) 4P+5.O2->2.P2O5
(2) P2O5+4.NaOH->2.Na2HPO4+H2O
b, photpho có n=6,2:31=0,2 mol.dựa theo pt (1) thấy nP2O5=0,1mol.theo pt (2) thấy nNaOH=0,4mol vậy mNaOH=0,4.40=16 g vậy m(dd NaOH)=16:32%=50 g
c, theo pt (2) nNa2HPO4 =0,2 mol vậy mNa2HPO4=0,2.142=28,4 g
m(dd sau pư)=mP+m(dd NaOH)=6,2+50=56,2 g
=> C%(dd Na2HPO4)=28,4:56,2=50,53%

Đáp án: A.
Hướng dẫn:
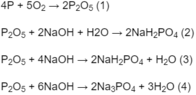
Số mol photpho: 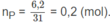
Số mol NaOH: ![]()
Sản phẩm tạo thành khi đốt photpho là P 2 O 5 .
Theo (1), số mol P 2 O 5 :
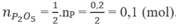
Ti lệ số mol NaOH và P 2 O 5 :
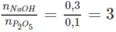
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là N a H 2 P O 4 và N a 2 H P O 4 .

a) 4P+5O2--->2P2O5
P2O5+4NaOH----->2 Na2HPO4+H2O
n\(_P=\frac{6,2}{32}=0,2\left(mol\right)\)
Theo pthh1
n\(_{P2O5}=\frac{1}{2}n_P=0,1\left(mol\right)\)
Theo pthh2
n\(_{NaOH}=4n_{P2O5}=0,4\left(mol\right)\)
mdd NaOH=\(\frac{0,4.40.100}{32}=50\left(g\right)\)
b) m dd sau pư=50+0,1.142=192(g)
Theo pthh
n\(_{Na2HPO4}=2n_{P2O5}=0,2\left(mol\right)\)
C%=\(\frac{0,2.142}{192}.100\%=14,79\%\%\)
\(\text{nP = 6,2 : 31 = 0,2 mol}\)
PTHH: 4P + 5O2 --t^o--> 2P2O5
.............0,2 ---------------------> 0,1 (mol)
P2O5 + 3H2O -> 2H3PO4
0,1 -----------------> 0,2 (mol)
H3PO4 + 2NaOH -> Na2HPO4 + 2H2O
0,2---------> 0,4 ----> 0,2.......................... (mol)
\(\text{a) mNaOH = 0,4.40 = 16 gam}\)
\(\Rightarrow\text{m dd NaOH = 16.(100/32) = 50 gam}\)
\(\text{b) m dd sau pư = mP2O5 + m dd NaOH = 0,1.142 + 50 = 64,2 gam}\)
\(\Rightarrow\text{C% Na2HPO4 =}\text{44,24%}\)


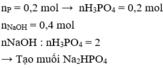

Theo pt: nNa2HPO4 = 2.nP2O5 = 0,1. 2 = 0,2 mol
Theo định luật bảo toàn khối lượng:
Khối lượng dung dịch sau phản ứng = khối lượng các chất tham gia phản ứng = mNaOH + mP2O5 = 50 + 0,1.142 = 64,2