Hòa tan 15,8g hỗn hợp Al,Mg,Fe vào 500ml dd HCl 2,5M thu được 13,44l khí H2 (đktc) va dung dịch A. Biết rằng trong hỗn hợp nMg = nAl
a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu
b)Tính khố lượng muối có trong dung dịch A
c)Tính Cm của dung dịch A. Biết thể tích dd không thay đổi



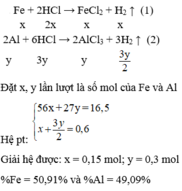
a, nH2 = 0,6 (mol)
nHCl = 1,25 (mol)
Thấy : nHCl > 2nH2 => HCl dư
Gọi x là số mol của Mg , Al ( do nMg = nAl ) , y là số mol của Fe
PT : Mg + 2HCl → MgCl2 + H2↑
Mol : x------> 2x----------------->x
2Al + 6HCl → 2AlCl3 + 3H2↑
Mol : x --->3x------------------> 3/2x
Fe + 2HCl → FeCl2 + H2↑
Mol : y------>2y----------------> y
Ta có : 51x+ 56y = 15,8 và 5/2x + y = 0,6
=> x= 0,2 , y=0,1
=> %mMg = \(\frac{24.0,2}{15,8}.100\%\)= 30,38 %
%mAl = \(\frac{27.0,2}{15,8}.100\%\) = 34,18%
=> %mFe = 100 - 30,38 - 34,18 = 35,44%
b, mHCl pu = (0,6 + 0,4 + 0,2 ) .36,5 = 43,8 (g)
ĐLBTKL : mmuối = 15,8 + 43,8 - (0,6.2) = 58,4 (g)
c, Dung dịch A gồm 0,2mol AlCl3 , 0,2 mol MgCl2 , 0,1 mol FeCl2 và 0,05 mol HCl dư
CMHCl = \(\frac{0,05}{0,5}\)= 0,1M
CMFeCl2 = \(\frac{0,1}{0,5}\)= 0,2M
CMAlCl3 = CMMgCl2 = \(\frac{0,2}{0,5}\) = 0,4M