Câu 3: Tính pH của dung dịch sau. a. HNO3 0,01M b. Ca(OH)2 0,0005M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(\left[H^+\right]=0,01.2=0,02M\)
=> pH = 1,7
b) \(\left[OH^-\right]=0,03.2=0,06M\)
=> pOH= 1,22
=> \(pH=14-1,22=12,78\)
a) pH= -log[H+]= -log[0,01.2]=1,69
b) pH= 14 - pOH= 14 + log[OH-]= 14+ log[0,03.2]=12,78

Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 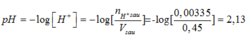

a) pH= -log[H+]= -log[0,1]=1
b) pH= 14- p[OH-]= 14+log[0,1]=13
Bạn ơi bạn có thể cho mình hỏi là pH=14-p(OH-) mà số 14 đó ở đâu ra được hem
