Cho 100 ml dung dịch HCl 7m hòa tan vừa hết 21,1 g hỗn hợp CuO và Al2O3. Tính khối lượng mỗi oxit.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. PTHH:
CuO + HCl ---x--->
Al2O3 + 6HCl ---> 2AlCl3 + 3H2O
b. Đổi 100ml = 0,1 lít
Ta có: \(n_{HCl}=7.0,1=0,7\left(mol\right)\)
Theo PT: \(n_{Al_2O_3}=\dfrac{1}{6}.n_{HCl}=\dfrac{1}{6}.0,7=\dfrac{7}{60}\left(mol\right)\)
=> \(m_{Al_2O_3}=\dfrac{7}{60}.102=11,9\left(g\right)\)
=> \(m_{CuO}=21,1-11,9=9,2\left(g\right)\)
Sửa:
a. PTHH:
CuO + 2HCl ------> CuCl2 + H2O (1)
Al2O3 + 6HCl ---> 2AlCl3 + 3H2O (2)
b. Đổi 100ml = 0,1 lít
Ta có: \(n_{HCl}=7.0,1=0,7\left(mol\right)\)
Gọi x, y lần lượt là số mol của CuO và Al2O3
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=6.n_{Al_2O_3}=6y\left(mol\right)\)
=> 2x + 6y = 0,7 (*)
Theo đề, ta có: 80x + 102y = 21,1 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+6y=0,7\\80x+102y=21,1\end{matrix}\right.\)
=> x = 0,2, y = 0,05
=> \(m_{CuO}=80.0,2=16\left(g\right)\)
\(m_{Al_2O_3}=21,1-16=5,1\left(g\right)\)

Đổi 200ml = 0,2 lít
Ta có: \(n_{HCl}=3,5.0,2=0,7\left(mol\right)\)
Gọi x, y lần lượt là số mol của CuO và Fe2O3
PTHH:
CuO + 2HCl ----> CuCl2 + H2O (1)
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O (2)
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=6.n_{Fe_2O_3}=6y\left(mol\right)\)
=> 2x + 6y = 0,7 (*)
Theo đề, ta có: 80x + 160y = 20 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+6y=0,7\\80x+160y=20\end{matrix}\right.\)
=> x = 0,05, y = 0,1
=> \(m_{CuO}=80.0,05=4\left(g\right)\)
\(m_{Fe_2O_3}=20-4=16\left(g\right)\)
đổi 200ml = 0.2 l
nhcl = 0.2*3.5 = 0.7 ( mol)
gọi số mol của CuO là x
số mol của Fe2O3 là y
PTHH:
CuO + 2HCl ➜ CuCl2 + H2O
x 2x
Fe2O3 + 6HCl ➜ 2FeCl3 + 3H2O
y 6y
ta có hệ phương trình
\(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\)
⇒ x= 0.05
y=0.1
mCuO= 0.05*80=4 (g)
mFe2O3= 0.1*160=16(g)

CuO+2HCl--->CuCl2+H2O
x 2x x x
Fe2O3+6HCl--->2FeCl3+3H2O
y 6y 2y 3y
nHCl=3,5.0,2=0,7 mol
gọi x y lần lượt là nCuO,nFe2O3
ta có x.80+y.160=20
2x+6y=0,7 giải hệ pt ta có x=0,05 y=0,1
mCuO=0,05.80=4g
mFe2O3=0,1.160=16g
%mCuO=4/20 .100%=20%
%mFe2O3=100%-20%=80%

Gọi x,y lần lượt là số mol Al2O3, CuO
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
CuO + H2SO4 → H2O + CuSO4
\(\left\{{}\begin{matrix}102x+80y=12,3\\3x+y=\dfrac{100.24,5\%}{98}=0,25\end{matrix}\right.\)
=> x= 0,056; y=0,082
=> \(\%m_{Al_2O_3}=\dfrac{0,056.102}{12,3}.100=46,44\%\)
=> %mCuO= 100 - 46,44= 53,56%
b)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
CuO + 2HCl → CuCl2 + H2O
=> \(m_{HCl}=\dfrac{(0,056.6+0,082.2).36,5}{7\%}=260,7\%\)

CuO + 2HCl -> CuCl2 + H2O (1)
Fe2O3 + 6HCl -> 2FeCl3 + 3H2O (2)
nHCl=0,2.3,5=0,7(mol)
Đặt nCuO=a
nFe2O3=b
Ta có hệ:
80a+160b=20
2a+6b=0,7
=>a=0,05;b=0,1
mCuO=80.0,05=4(g)
mFe2O3=20-4=16(g)
Theo PTHH 1 và 2 ta có:
nCuCl2=nCuO=0,05(mol)
nFeCl3=2nFe2O3=0,2(mol)
mCuCl2=135.0,05=6,75(g)
mFeCl3=162,5.0,2=32,5(g)
mdd =20+200.1,1=240(g)
C% dd CuCl2=6,72\240 .100%=2,8125%
C% dd FeCl3= 32,5\240 .100%=13,54%

Câu 3:
Gọi x, y lần lượt là số mol của MgO và Al2O3
Ta có: \(n_{H_2SO_4}=0,2.250:1000=0,05\left(mol\right)\)
a. PTHH:
MgO + H2SO4 ---> MgSO4 + H2O (1)
Al2O3 + 3H2SO4 ---> Al2(SO4)3 + 3H2O (2)
b. Theo PT(1): \(n_{H_2SO_4}=n_{MgO}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2SO_4}=3.n_{Al_2O_3}=3y\left(mol\right)\)
=> x + 3y = 0,05 (1)
Theo đề, ta có: 40x + 102y = 1,82 (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}x+3y=0,05\\40x+102y=1,82\end{matrix}\right.\)
=> x = 0,02, y = 0,01
=> \(m_{MgO}=0,02.40=0,8\left(mol\right)\)
=> \(\%_{m_{MgO}}=\dfrac{0,8}{1,82}.100\%=43,96\%\)
\(\%_{m_{Al_2O_3}}=100\%-43,96\%=56,04\%\)
Câu 4:
Ta có: \(m_{H_2SO_4}=\dfrac{19,6\%.100\%}{100}=19,6\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Ta lại có: \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
a. PTHH: CuO + H2SO4 ---> CuSO4 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\)
Vậy H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{CuO}=0,1\left(mol\right)\)
=> \(m_{CuSO_4}=0,1.160=16\left(g\right)\)
Ta có: \(m_{dd_{CuSO_4}}=8+100=108\left(g\right)\)
=> \(C_{\%_{CuSO_4}}=\dfrac{16}{108}.100\%=14,81\%\)
Câu 5: Thiếu đề
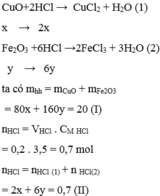
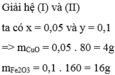
\(n_{HCl}=0,1.7=0,7\left(mol\right)\\ Đặt:n_{CuO}=a\left(mol\right);n_{Al_2O_3}=b\left(mol\right)\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ \Rightarrow\left\{{}\begin{matrix}80a+102b=21,1\\2a+6b=0,7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,05\end{matrix}\right.\\ \Rightarrow\%m_{CuO}=\dfrac{0,2.80}{21,1}.100\approx75,829\%\\ \Rightarrow\%m_{Al_2O_3}\approx24,171\%\)
100ml=0,1l
\(n_{HCl}=CM.V_{dd}\)=7.0,1=0,7(mol)
gọi x,y lần lượt là số mol của\(CuO\) và\(Al_2O_3\)
PTHH1:\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
x 2x x x
PTHH2:\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
y 6y 2y 3y
ta có hệ pt:\(\left\{{}\begin{matrix}m_{CuO}+m_{Al_2O_3}=21,1\left(g\right)\\n_{HCl\left(1\right)}+n_{HCl\left(2\right)}=0,7\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}80x+102y=21,1\left(g\right)\\2x+6y=0,7\left(mol\right)\end{matrix}\right.\)
giải ra ta được:x=0,2;y=0,05
\(m_{CuO}=n.M\)=0,2.80=16(g)
\(m_{Al_2O_3}=n.M\)=0,05.102=5,1(g)