1.Hòa tan 5,72 g Na2CO3 ngậm nước trong 44,28 g nước ta được một dung dịch có nồng độ 4,24%. Xác định công thức phân tử của hiđrat ?
2. Có sẵn dung dịch HNO3 40% ( D = 1,25g/ml) và dung dịch HNO3 10% ( D = 1,06 g/ml). Hãy tính toán và trình bày cách pha thành 2 lít dung dịch HNO3 15% ( D = 1,08 g/ml)

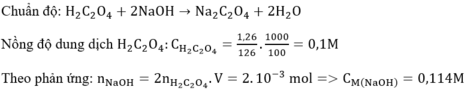
Câu 1:
Gọi số mol Na2CO3 là x mol => n(tinh thể) = x mol
C%=106x:(5,72+44,28).100%=4,24%
=> x=0,02
=> 0,02(106+18n)=5,72
=> n=10
=> công thức là Na2CO3.10H2O.
Câu 2:
Gọi A, B lần lượt là thể tích của dung dịch HNO3 40% và dung dịch HNO3 10%
Ta có: A+B=2 (1)
Sơ đồ đường chéo:
A 40 5A 40 5
↘ ↗ ↘ ↗
15 15
↗ ↘ ↗ ↘
B 10 25B 10 25
=> A/B=5/25=1/5
=> A=5B (2)
Từ (1) và (2) => A=1,67; B=0,33
Vậy cần dùng 1,67 lít dung dịch HNO3 40% (D=1,25g/ml)
0,33 lít dung dịch HNO3HNO3 10% (D=1,06g/ml)