nhiệt phân 15,8 KMnO4 thu được lượng oxi. Đốt cháy 5,6 gam sát trong lượng oxi vừa thu đc thì sản phẩm sau phản ứng có bị hút vaò nam châm k
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2KMnO4 \(\xrightarrow[]{t^o}\) K2MnO4 + MnO2 + O2(1)
3Fe + 2O2 \(\xrightarrow[]{t^o}\) Fe3O4(2)
nKMnO4 = 15,8 : 158 = 0,1 mol
nFe = 5,6 : 56 = 0,1 mol
Theo pt 1 nO2 = \(\dfrac{1}{2}nKMnO_4=0,05mol\)
Lập tỉ lệ phương trình (2)
nFe : nO2 = \(\dfrac{0,1}{3}:\dfrac{0,05}{2}\)
Do 0,1/3 > 0,05/2 => Fe dư
Vậy sản phẩm thu được có Fe dư => bị nam châm hút

Bài 1:
| Đơn chất | Hợp chất |
| S, O2 | NaCl, MgSO4, KCl, P2O5 |
Bài 2:
a) AgNO3
CTHH AgNO3 mang ý nghĩa:
- Là hợp chất tạo bởi 3 nguyên tố hóa học : Ag , N và O
- Tạo bởi 1 nguyên tử nguyên tố Ag, 1 nguyên tử nguyên tố N và 3 nguyên tử nguyên tố O.
- \(PTK_{AgNO_3}=NTK_{Ag}+NTK_N+3.NTK_O\\ =108+14+3.16=170\left(đ.v.C\right)\)
b) KHSO4
CTHH KHSO4 mang ý nghĩa:
- Là hợp chất cấu tạo từ 4 nguyên tố hóa học: K,H,S và O
- Cấu tạo bởi 1 nguyên tử nguyên tố K, 1 nguyên tử nguyên tố H, 1 nguyên tử nguyên tố A và 4 nguyên tử nguyên tố O.
- \(PTK_{KHSO_4}=NTK_K+NTK_H+NTK_S+4.NTK_O\\ =39+1+32+4.16=136\left(đ.v.C\right)\)
Bài tập 3:
a) Gọi CT ghi hóa trị của S(IV) và O là \(S_x^{IV}O_y^{II}\)(x,y : nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(x.IV=y.II\\ =>\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\)
=> x=1; y=2
=> CTHH là SO2
b) Gọi CT ghi hóa trị của Al(III) và Cl(I) là \(Al_x^{III}Cl_y^I\) (x,y: nguyên, dương)
Theo quy tắc hóa trị ta có:
\(x.III=y.I\\ =>\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\)
=> x=1; y=3
=> CTHH là AlCl3
Bài 4:
a) Gọi CT gọi hóa trị của hợp chất CuCl2 là \(Cu^aCl_2^b\)(a,b: nguyên, dương)
Theo Quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\)
=> a= II, b=I
=> Trong hợp chất CuCl2 : Cu(II) và Cl(I)
b) Gọi CT kèm hóa trị của hợp chất Fe(NO3)2 là: \(Fe^a\left(NO_3\right)_2^b\) (a,b: nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\\ =>a=II;b=I\)
=> Trong hợp chất Fe(NO3)2 : Fe(II) và nhóm nguyên tử NO3 (I)

Phương trình hóa học:
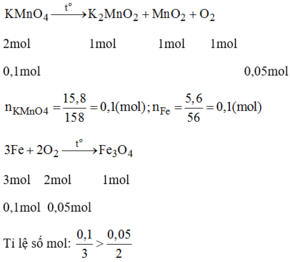
Vậy sắt còn dư nên khi đưa nam châm lại gần sản phẩm sau phản ứng thì nam châm bị hút.

PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a. Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12\left(l\right)\)
b. PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có: \(\dfrac{1}{n_{O_2}}=\dfrac{1}{0,05}\)
\(\dfrac{1}{n_{Fe}}=\dfrac{1}{0,1}\)
\(\Rightarrow\dfrac{1}{n_{O_2}}>\dfrac{1}{n_{Fe}}\)
Vậy Fe dư
Theo PTHH: \(n_{Fe_3O_4}=\dfrac{0,1.1}{3}=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,73g\)

2KMnO4→→K2MnO4+MnO2+O2
\(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{15,8}{158}=0,05mol\\ n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ 3Fe+2O_2\rightarrow Fe_3O_4\\ \dfrac{0,1}{3}\approx0,33>\dfrac{0,05}{2}=0,25\)
Suy ra Fe dư=0,1-0,05.3:2=0,025 mol. Vậy sản phẩm gồm Fe3O4 và Fe dư nên nam châm vẫn hút.
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: \(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\uparrow\left(1\right)\)
Theo PTHH(1): \(n_{O_2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
PTHH (2): \(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\left(2\right)\)
\(\left\{{}\begin{matrix}\dfrac{n_{Fe}}{3}=\dfrac{0,1}{3}=0,03\\\dfrac{n_{O_2}}{2}=\dfrac{0,05}{2}=0,025\end{matrix}\right.\) \(\Rightarrow\) Fe dư. O2 phản ứng hết
Vậy Fe còn dư nên sản phẩm sau ohanr ứng bị nam châm hút.

a, nZn = 13/65 = 0,2 (mol)
PTHH: 2Zn + O2 -> (t°) 2ZnO
Mol: 0,2 ---> 0,1 ---> 0,2
b, VO2 = 0,1 . 22,4 = 2,24 (l)
c, mZnO = 0,2 . 81 = 16,2 (g)
d, PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,1 . 2 = 0,2 (mol)
mKMnO4 = 0,2 . 158 = 31,6 (g)

C1:
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,2 . 2 = 0,4 (mol)
mKMnO4 = 0,4 . 158 = 63,2 (g)
C2:
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,4/32 = 0,2 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,2/4 > 0,2/5 => P dư
nP2O5 = 0,2/5 . 2 = 0,08 (mol)
mP2O5 = 0,08 . 142 = 11,36 (g)

a, Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
b, \(n_{H_2O}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,3.18=5,4\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
_______0,3_______________________0,15 (mol)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Bạn tham khảo nhé!
2KMnO4\(\rightarrow\)K2MnO4+MnO2+O2
\(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{15,8}{158}=0,05mol\)
nFe=\(\dfrac{5,6}{56}=0,1mol\)
3Fe+2O2\(\rightarrow\)Fe3O4
\(\dfrac{0,1}{3}\approx0,033>\dfrac{0,05}{2}=0,025\)
Suy ra Fe dư=0,1-0,05.3:2=0,025 mol. Vậy sản phẩm gồm Fe3O4 và Fe dư nên nam châm vẫn hút.