Hoà tan 9,2 gam hỗn hợp X gồm Fe và Fe3O4 bằng HNO3 loãng (dư), thu được 1,12 lít khí NO (ở đktc,
NO là sản phẩm khử duy nhất của N+5) và dung dịch Y.
a) Viết các PTHH (dạng phân tử) của các phản ứng xảy ra.
b) Tính thành phần % khối lượng các chất trong X. [% Fe3O4 = 75,65%]
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

5 tháng 12 2018
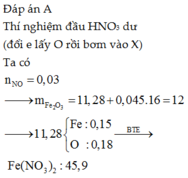
Đáp án : A
X gồm x mol Al2O3 ; y mol Fe3O4 ; z mol Fe
=> mX = 102x + 232y + 56z = 47,8g
Bảo toàn e : nFe3O4 + 3nFe = 3nNO => y + 3z = 0,3 mol
Kết tủa gồm Al(OH)3 và Fe(OH)3 (vì HNO3 dư nên chỉ có Fe3+)
=> 156x + 107(3y + z) = 69,1g
=> x = 0,1 ; y = 0,15 ; z = 0,05
=> %mFe = 5,86%

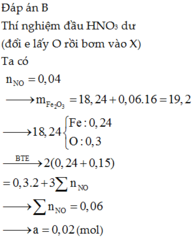

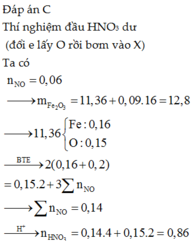



a)
$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$3Fe_3O_4 + 28HNO_3 \to 9Fe(NO_3)_3 + NO + 14H_2O$
b)
Gọi $n_{Fe} = a(mol) ; n_{Fe_3O_4} = b \Rightarrow 56a + 232b = 9,2(1)$
$n_{NO} = a + \dfrac{1}{3}b = 0,05(2)$
Từ (1)(2) suy ra a = 0,04 ; b = 0,03
$\%m_{Fe} = \dfrac{0,04.56}{9,2}.100\% = 24,35\%$
$\%m_{Fe_3O_4} = 75,65\%$