

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C
Fe + ddZ → khí NO => X chứa H N O 3 dư. Quy X về Fe và O
Trong X, đặt ![]()
Bảo toàn electron:
![]()
Giải hệ có: x = 0,12 mol; y = 0,09 mol
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
![]()
![]()
![]()

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12;b=0,09$
Bảo toàn e cho phản ứng (2) ta có: $n_{NO}=0,02(mol)\Rightarrow n_{H^+/du}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$
Coi hỗn hợp X gồm : Fe , O
\(n_{Fe}=a\left(mol\right),n_O=b\left(mol\right)\)
\(m_X=56a+16b=8.16\left(g\right)\left(1\right)\)
\(n_{NO}=\dfrac{1.344}{22.4}=0.06\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(3a=2b+3\cdot0.06\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.12,b=0.09\)
\(\text{Bảo toàn e cho cả quá trình : }\)
\(2n_{Fe}=3n_{NO\left(1\right)}+2n_{NO\left(2\right)}\)
\(\Rightarrow n_{NO\left(2\right)}=0.08\)
\(n_{HNO_3}=0.5\left(mol\right)\)

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b(mol)
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12'b=0,09$
Bảo toàn e cho phản ứng (2) ta có:
$n_{NO}=0,02(mol)\Rightarrow n_{H^+/dư}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$

Đáp án C
Bài toán nhỏ “cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 tan hết trong dung dịch HNO3 loãng (dung dịch Y) thu được 1,344 lít NO (đktc) và dung dịch Z” → đủ giả thiết
Quy đổi 8,16 gam X gồm x mol Fe và y mol O → 56x + 16y = 8,16
Do thêm Fe vào Z tiếp tục thu được NO → chứng tỏ HNO3 còn dư trong Z → muối Fe trong Z là muối Fe3+
Bảo toàn electron ta có: 3x = 2y + 0,06.3.
Kết hợp giải hệ được x = 0,12mol, y = 0,09mol
Hòa tan tối đa Fe nên dung dịch sản phẩm cuối cùng chỉ chứa muối sắt II
Gộp cả quá trình → quan sát:
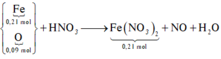
Bảo toàn electron có nNO = (0,21.2 – 0,09.2) : 3 = 0,08mol
Bảo toàn nguyên tố N có số mol HNO3 là 0,08 + 0,21.2 = 0,5mol