Cho 11,4gam hỗn hợp A gồm Mg và Al tác dụng vừa đủ với dung dịch axit sunfuric
19,6%, sau phản ứng thu được dung dịch B và khí 12,32 lít khí hiđro thoát ra ( đo ở
ĐKTC)
a. Viết các PTHH xảy ra.
b. Tính khối lượng mỗi kim loại trong hỗn hợp A
c. Tính khối lượng axit axit sunfuric tham gia phản ứng.
d. Tính nồng độ phần trăm của chất tan trong dung dịch B

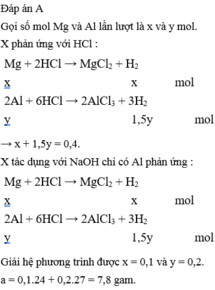
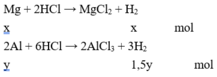
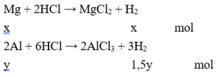
\(n_{H_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2SO_4+3H_2\)
2x..........3x.................x................3x
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
y............y.................y...............y
\(\left[{}\begin{matrix}3x+y=0,55\\54x+24y=11,4\end{matrix}\right.\)
\(\Leftrightarrow\left[{}\begin{matrix}x=0,1\left(mol\right)\\y=0,25\left(mol\right)\end{matrix}\right.\)
b) \(m_{Al}=2.0,1.27=5,4\left(g\right)\)
\(m_{Mg}=11,4-5,4=6\left(g\right)\)
c)\(m_{H_2SO_4pu}=98.\left(3.0,1+0,25\right)=53,9\left(g\right)\)
d) \(m_{ddH_2SO_4}=\dfrac{53,9.100\%}{19,6\%}=275\left(g\right)\)
\(m_{ct}=m_{Al_2\left(SO_4\right)_3}+m_{MgSO_4}=0,1.342+0,25.120=64,2\left(g\right)\)
\(C\%=\dfrac{64,2}{11,4+275-0,55.2}.100\%=22,5\%\approx\approx\approx\approx\approx0\)
Theo đề bài ta có :
nH2=12,32/22,4=0,55(mol)
Gọi số mol của H2 thu được ở pthh 1 là x
số mol của H2 thu được ở pthh 2 là 0,55-x
a) Ta có pthh :
\(\left(1\right)Mg+H2SO4\rightarrow MgSO4+H2\uparrow\)
xmol............................................xmol
\(\left(2\right)2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\uparrow\)
2/3(0,55-x)mol..........................................0,55-x
b) Ta có hệ pt :
24x + 27.2/3(0,55-x) = 11,4
Giải ra ta được : x= 0,25 (mol)
=> nMg=0,25 mol
=> mMg=0,25.24=6(g)
=> mAl=11,4-6=5,4(g)
c) Ta có : nH2SO4=nH2=0,55 mol
=> mct=mH2SO4=\(\dfrac{\left(0,55.98\right).100}{19,6}=275g\)
vậy khối lượng của ddH2SO4 cần dùng là 275g
d) Dung dịch B thu được là MgSO4 và Al2(SO4)3
Ta có : nMgSO4=nMg=0,25 mol
=> mMgSO4=0,25.120=30(g)
nAl2(SO4)3 = 1/2nAl=1/2.(0,55-0,25)=0,15(mol)
=> mAl2(SO4)3=0,15.342=51,3 (g)
Ta có : mdd(thu được sau p/ư)=mhh+mddH2SO4-mH2=11,4+275-(0,55.2)=285,3 (g)
\(\Rightarrow\left\{{}\begin{matrix}CM_{MgSO4}=\dfrac{30}{285,3}.100\%\approx10,52\%\\CM_{Al2\left(SO4\right)3}=\dfrac{51,3}{285,3}.100\%\approx17,98\%\end{matrix}\right.\)