cho a gam na vào p gam h2o thu được dd naoh x%. cho b gam na2o vào p gam h2o cũng thu được dd naoh x%. lập biểu thức tính p theo a và b
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Na_2O}=\dfrac{a}{62}\left(mol\right)\)
\(m_{NaOH}=\dfrac{400.1,15}{100}=4,6\left(g\right)\)
PTHH: Na2O + H2O --> 2NaOH
\(\dfrac{a}{62}\)------------->\(\dfrac{a}{31}\)
=> \(m_{NaOH}=\dfrac{40a}{31}=4,6\left(g\right)\) => a = 3,565 (g)
=> mdd sau pư = a + m = 400 (g) => m = 396,435 (g)

Đáp án : C.
Xét Na : n H 2 = 1 2 n N a = a 46 m o l
Bảo toàn khối lượng :
mdd sau = mNa + m H 2 O – m H 2 = a + p – 2. a 46 (g)
=> C%NaOH = x %
Xét Na2O
=> mdd sau = m N a 2 O + m H 2 O = b + p
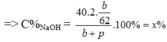
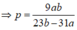

Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{15,6}{78}=0,2\left(mol\right)\), \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BTNT Al, có: nAl = nAl(OH)3 = 0,2 (mol)
BT e,có: nNa + 3nAl = 2nH2 ⇒ nNa = 0,2 (mol)
\(\Rightarrow m=m_{Na}+m_{Al}=10\left(g\right)\)

Cho V lít = 1 lít ; số lít coi như là số mol cho dễ tính
Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al
Còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%

Đáp án : C
+) TH1 :Nếu tạo ra số mol OH bằng nhau
=> nX = nY => 17,55/X = 14,95/Y
=> X : Y = 27 : 23
=>Không có chất thỏa mãn
+) TH2 : Nếu với X thì Al3+ dư còn Y thì kết tủa hòa tan 1 phần
=> nAl(OH)3 = 1/3 nX = 5,85/X < 0,2 => X > 29,25g
Và y = 4.0,2 – 14,95/Y = 5,85/X
Nếu X = 39 => Y = 23g (Na) => nAl(OH)3 = 0,15 mol
=> y = 11,7g (có đáp án thỏa mãn)

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
Theo đề bài ta có :
nNa=\(\dfrac{a}{23}mol\)
Ta có PTHH : 1
\(2Na+2H2O\rightarrow2NaOH+H2\)
a/23.........a/23.........a/46
X=\(\dfrac{mct\left(mNaOH\right)}{m\text{dd}NaOH}.100\%=\dfrac{\left(\dfrac{a}{23}\right).40}{a+p-\left(\dfrac{a}{46}\right)}=\dfrac{40a}{23a+23p}\)(1)
Ta có : nNa2O=\(\dfrac{b}{62}mol\)
PTHH 2 :
\(Na2O+H2O\rightarrow2NaOH\: \)
b/62mol................2.(b/62)mol
=> X=\(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{\left(2.\left(\dfrac{b}{62}\right)\right).40}{b+p}=\dfrac{40b}{124b+124p}\left(2\right)\)
Ta cho (1)=(2)
ta có biểu thức :
\(\dfrac{40a}{23a+23p}=\dfrac{40b}{124b+124p}\)
Bạn tự rút gọn biểu thức nhé!
CHO MÌNH CHỮA LẠI 1 CHÚT nãy ghi nhầm =.=
Theo đề bài ta có :
nNa=\(\dfrac{a}{23}mol\)
PTHH 1 :
\(2Na+2H2O\rightarrow2NaOH+H2\uparrow\)
a/23mol..................2(a/23)mol....1/2(a/23)mol
=> X=\(\dfrac{mct}{m\text{dd}}.100\%=\dfrac{40.2.\left(\dfrac{a}{23}\right)}{a+p-2.\dfrac{1}{2}\left(\dfrac{a}{23}\right)}\)=\(\dfrac{80a}{23a+23p}\)(1)
Theo đề bài ta có :
nNa2O=\(\dfrac{b}{62}mol\)
PTHH 2 :
\(Na2O+H2O\rightarrow2NaOH\)
b/62mol.................2(b/62)mol
=> X= \(\dfrac{mct}{m\text{đ}}.100\%=\dfrac{40.2\left(\dfrac{b}{62}\right)}{b+p}=\dfrac{80b}{62b+62p}\left(2\right)\)
Cho (1)=(2)
Ta có biểu thức : \(\dfrac{80a}{23a+23p}\)= \(\dfrac{80b}{62b+62p}\)