cho 8,4 gam bột sắt vào 100 ml dung dịch CuSO4 1M (D=1,08g/ml) đến khi phản ứng kết thúc thu được chất rắn X và dung dịch Y. Hòa tan X trong dung dịch HCl dư thấy còn lại a g chất rắn không tan. Tính a và nồng độ % chất tan trong dung dịch Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
.0,05...0,05............0,05.....0,05.....
Thấy : \(\dfrac{1.n_{Fe}}{1.n_{CuSO_4}}=\dfrac{0,1}{0,05}=2>1\)
=> Sau phản ứng thu được 0,05 mol FeSO4, 0,05 mol Fe dư, 0,05 mol Cu .
Thấy Cu không phản ứng với HCl .
\(\Rightarrow m=m_{Cu}=3,2\left(g\right)\)
b, \(m_{ddY}=5,6+108-3,2-2,8=107,6\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{0,05\left(56+96\right)}{107,6}.100\%\approx7,06\%\)

a) Fe+CuSO4--->FeSO4+Cu(1)
Fe+2HCl--->FeCl2+H2
b)nFe=8,4/56=0,15(mol)
nCuSO4=0,1.1=0,1(mol)
----> Fe dư
chất rắn X là Fe, Cu
dd Y là FeSO4
theo pthh1: nCu=nCuSO4=nFeSO4=0,1(mol)
mCu=a=0,1.64=6,4(g)
c)mddCuSO4=1,08.100=108(g)
mdd sau pứ=108+8,4-6,4=110(g)
⇒ C%FeSO4=0,1.152/110.100≈13,82%

PTHH: Fe + CuSO4 -> FeSO4 + Cu
vậy X là Cu Y là FeSO4 p k bn?

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
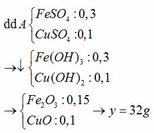

Ta có: $n_{Al}=n_{Fe}=0,1(mol)$
Sau phản ứng thì Al hết, Fe chưa phản ứng hoặc còn dư
Gọi số mol $Cu(NO_3)_2 và $AgNO_3$ lần lượt là a;b
Ta có: $64a+108b=28$
Bảo toàn e toàn bộ quá trình ta có: $2a+b=0,4$
Giải hệ ta được $a=0,1;b=0,2$
$\Rightarrow [Cu(NO_3)_2]=1M;[AgNO_3]=2M$
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0.05\left(mol\right)\)
\(n_{Al}=n_{Fe}=a\left(mol\right)\)
\(\Rightarrow a=\dfrac{8.3}{27+56}=0.1\)
\(n_{AgNO_3}=x\left(mol\right),n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\)
\(m_{cr}=108x+64y=28\left(1\right)\)
Bảo toàn e :
\(x+2y=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
\(C_{M_{AgNO_3}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0.1}{0.1}=1\left(M\right)\)

Đáp án D
nFe = 0,045; nHCl = 0,13
Fe + 2H+→ Fe2+ + H2
0,045 → 0,09 → 0,045
3Fe2+ + 4H+còn dư + NO3-→ 3Fe3+ + NO + 2H2O
0,03← 0,4
=> Fe2+ còn dư 0,015
Fe2+ + Ag+→ Fe3+ + Ag
Cl- + Ag+→ AgCl
=> m = 0,015.108 + 0,13.143,5 = 20,275 => Chọn D.






\(Fe\left(0,1\right)+CuSO_4\left(0,1\right)\rightarrow FeSO_4\left(0,1\right)+Cu\left(0,1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\frac{8,4}{56}=0,15\)
\(m_{ddđ}=100.1,08=108\)
\(n_{CuSO_4}=0,1.1=0,1\)
Ta thấy \(\frac{0,15}{1}>\frac{0,1}{1}\) nên Fe còn dư CuSO4 hết
\(\Rightarrow a=m_{Cu}=0,1.64=6,4\)
\(\Rightarrow m_{Fe\left(pứ\right)}=0,1.56=5,6\)
\(\Rightarrow m_Y=108+5,6-6,4=107,2\)
\(m_{FeSO_4}=0,1.152=15,2\)
\(\Rightarrow C\%\left(FeSO_4\right)=\frac{15,2}{107,2}.100\%=14,18\%\)