một dung dịch có \(\left[OH^-\right]=1,5\times10^{-5}M\) . Môi trường của dung dịch này là axit , trung tính hay kiềm ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


[OH-]=1.10^-14/0.01=10^-12 (M) tính Ph=log[H+] từ kết quả của Ph xem nó lớn hơn 7 hay j xong suy ra môi trường ,môi trường axit thì quỳ đỏ môi trường kiềm quy xanh trung tính ko màu

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
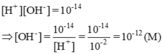
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
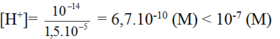
Vậy môi trường của dung dịch là kiềm.

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

Đáp án C
- Axit fomic hòa tan Cu(OH)2 theo phản ứng axit - bazơ.
- Fructozơ và etylen glicol chứa các nhóm -OH kề nhau nên hòa tan Cu(OH)2 tạo phức màu xanh lam.
- Anbumin (lòng trắng trứng) có phản ứng màu biure với Cu(OH)2 trong môi trường kiềm.
- Tinh bột tuy cũng chứa các nhóm OH kề nhau nhưng không phản ứng được với Cu(OH)2. Do cấu trúc mạch tinh bột (amilozơ và amilopectin) không kéo dài mà xoắn lại thành hạt có lỗ rỗng, cấu trúc mạch phân nhánh cồng kềnh (amilopectin) nên che khuất các nhóm -OH. Bên cạnh các yếu tố trên thì khối lượng phân tử lớn, cồng kềnh làm cho độ nhớt của dung dịch rất lớn; liên kết hiđro hình thành giữa các nhóm -OH làm mất tính tự do của chúng.
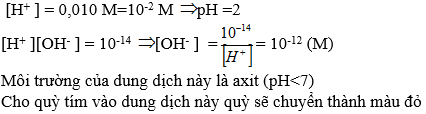
Mình không chắc lắm, bạn tham khảo thử nhé!
pOH = -log(1,5x10-5) = 4,8
pH = 14 - 4,8 = 9,2 → môi trường của dung dịch là kiềm