Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đáp án C
- Từ [OH-]= 1,5.10-5 (M) suy ra:
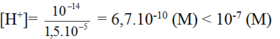
Vậy môi trường của dung dịch là kiềm.

[H+] = 0,010M = 10-2M ⇒ pH = -log[H+] = -log(1,0.10-2) = 2
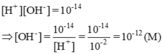
Môi trường của dung dịch này là axit (pH < 7)
Cho quỳ tím vào dung dịch này quỳ sẽ chuyển thành màu đỏ

Mình không chắc lắm, bạn tham khảo thử nhé!
pOH = -log(1,5x10-5) = 4,8
pH = 14 - 4,8 = 9,2 → môi trường của dung dịch là kiềm

- Đáp án B.
- Vì tích số ion của nước là hằng số trong nước và cả trong các dung dịch loãng của các chất khác nhau.

[H+] = 0,01M = 10-2M => pH = 2
[OH-] = 10-14 / 10-2M =10-12
Dung dịch có pH = 2 < 7 => môi trường axit, quỳ tím có màu đỏ.

[OH-]=1.10^-14/0.01=10^-12 (M) tính Ph=log[H+] từ kết quả của Ph xem nó lớn hơn 7 hay j xong suy ra môi trường ,môi trường axit thì quỳ đỏ môi trường kiềm quy xanh trung tính ko màu

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.
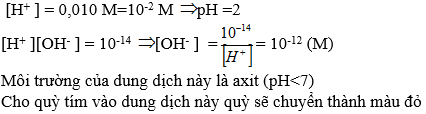


Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D
Chọn C