Ngâm 21,6g hỗn hợp 3 kim loại Zn ,Fe,Cu trong dung dịch H2SO4 Phản ứng thu được 3g chất rắn không tan và 6,72 lít khí đktc
Xác định % Khối lượng của mỗi chất trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
mhh Zn và Fe = 21,6-3 = 18,6 (g)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: x x
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{Zn}=\dfrac{0,2.65.100\%}{21,6}=60,19\%\)
\(\%m_{Fe}=\dfrac{0,1.56.100\%}{21,6}=25,93\%\)
\(\%m_{Cu}=100-60,19-25,93=13,88\%\)
b,
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,2 0,2 0,2
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{H_2SO_4}=\left(0,1+0,2\right).98=29,4\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{29,4.100\%}{25\%}=117,6\left(g\right)\)
c,mdd sau pư = 21,6+117,6- (0,1+0,2).2 = 138,6 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,2.161.100\%}{138,6}=23,23\%\)
\(C\%_{ddFeSO_4}=\dfrac{0,1.152.100\%}{138,6}=10,97\%\)

a) Đặt: nZn=x(mol); nFe= y(mol) (x,y: nguyên, dương)
Zn + H2SO4 -> ZnSO4 + H2
x_______x_______x________x
Fe + H2SO4 -> FeSO4 + H2
y____y_________y___y(mol)
b) m(rắn)=mCu=3(g)
=> m(Zn, Fe)= 21,6 - 3= 18,6(g)
Ta có hpt:
\(\left\{{}\begin{matrix}65x+56y=18,6\\22,4x+22,4y=6,72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
=> Zn= 65.0,2=13(g)
=>%mZn= (13/21,6).100=60,185%
%mCu=(3/21,6).100=13,889%
=>%mFe=25,926%
c) nH2SO4=x+y=0,3(mol) =>mH2SO4=29,4(g)
=> mddH2SO4= (29,4.100)/25=117,6(g)

a)Zn +H2SO4 -> ZnSO4 +H2
Fe +H2SO4 -> FeSO4 +H2
Cu +H2SO4 -> CUSO4+H2
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2 x 65 x100/21.6 = 60.185%
%Fe=0.1 x 56 x 100/21.6 = 25.925%
%Cu=100%-( 60.185% + 25.925% )= 13.89%

3g chất rắn không tan là Cu
=> \(m_{Zn}+m_{Fe}=18,6\left(g\right)\)
Theo đề bài ta có PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (I)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (II)
Gọi \(n_{Zn}=x\left(mol\right);n_{Fe}=y\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=56\cdot0,1=5,6\left(g\right)\) ; \(m_{Zn}=65\cdot0,2=13\left(g\right)\)
\(\%m_{Fe}=\dfrac{5,6}{21,6}\cdot100\%=25,93\left(\%\right)\)
\(\%m_{Zn}=\dfrac{13}{21,6}\cdot100\%=60,19\left(\%\right)\)
\(\%m_{Cu}=\left(100-25,93-60,19\right)\%=13,88\%\)

Đặt nZn = x mol; nFe = y mol.
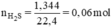
Ta có hệ phương trình: 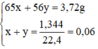
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%
phương trình bn tự ghi nha:
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2x65x100/21.6=60.185%
%Fe=0.1x56x100/21.6=25.925%
%Cu=100%-(60.185%+25.925%)=13.89%
Bạn tính số mol Zn và Fe như thế nào vậy?