cho 1,68lit CO2(dktc) sục vào bình đựng dung dịch KOH dư . Tính nồng độ mol/lít của muối thu được sau phản ứng. Biết thể tích dung dịch là 250ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$2KOH + CO_2 \to K_2CO_3 + H_2O$
$n_{K_2CO_3} = n_{CO_2} = \dfrac{1,68}{22,4} = 0,075(mol)$
$V_{dd} = V_{dd\ KOH} = 0,25(lít)$
$C_{M_{K_2CO_3}} = \dfrac{0,075}{0,25} = 0,3M$
nCO2=0,075(mol)
PTHH: CO2 + 2 KOH -> K2CO3 + H2O
Vddmuoi= VddKOH=0,25(l)
=> nK2CO3=nCO2=0,075(mol)
=>CMddK2CO3=0,075/0,25=0,3(M)

Chọn B
n C O 2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
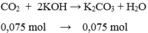
Vì thể tích dung dịch trước và sau không thay đổi


nCO2=0,075 mol
CO2 + 2KOH => K2CO3 + H2O
0,075 mol =>0,075 mol
CM dd K2CO3=0,075/0,25=0,3M

nCO2=0,075mol
do dư KOH nên tạo ra muối trung hòa
nNa2CO3=nCO2=0,075mol
-->Cm=0,3M
Bạn phài gthich rõ :
Xét k=nKOH/nCO2=0.25/0.075=3.33
Vì k>2 nên xr phản ứng tạo muối trung hòa và có KOH dư
=>nKOH dư=0.25-(2*0.075)=0.1(mol)
=>CM(KOH dư)= 0.1/0.25=0.4(mol)

nCO2 = 0,2 (mol)
nKOH = 0,5 (mol)
Pt: CO2 + KOH --->K2CO3 + H2O
Sau phản ứng nCO2 dư = 0,05(mol)
=> nK2CO3 = 0,2 mol => CM = n/V=0,2/0,25 =0,8 (mol/lit)
\(n_{CO2}=0,2\left(mol\right)\)
\(n_{KOH}=0,25.2=0,5\left(mol\right)\)
TH1 : \(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
______0,2______0,4______0,2_________
\(CM_{K2CO3}=\frac{0,2}{0,25}=0,8M\)
TH2: \(CO_2+KOH\rightarrow KHCO_3\)
_____0,2____________ 0,2
\(CM_{KHCO3}=0,8M\)

a)
$KOH + SO_2 \to KHSO_3$
Theo PTHH : $n_{KOH} = n_{KHSO_3} = n_{SO_2} = 0,4.0,5 = 0,2(mol)$
$V_{SO_2} = 0,2.22,4 = 4,48(lít)$
$C_{M_{KHSO_3}} = \dfrac{0,2}{0,4} = 0,5M$
b)
$2KOH + SO_2 \to K_2SO_3 + H_2O$
$n_{K_2SO_3} = n_{SO_2} = \dfrac{1}{2}n_{KOH} = 0,1(mol)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
$C_{M_{K_2SO_3}} = \dfrac{0,1}{0,4} = 0,25M$
nCO2=0,075 mol
CO2 + 2KOH => K2CO3 + H2O
0,075 mol =>0,075 mol
CM dd K2CO3=0,075/0,25=0,3M
cảm ơn chị