Câu 1: Cho 11,2 gam Fe tác dụng với dung dịch HCl .Tính:a. Thể tích khí H2 thu được ở đktc.(ĐS:4,48 lít) b. Khối lượng HCl phản ứng.(ĐS:14,6 g)c. Khối lượng FeCl2 tạo thành.(ĐS:25,4 g)Câu 2 : Sắt tác dụng axit clohiđric : Ta có phương trình hóa học sau : Nếu 1,4g Fe tham gia phản ứng hết với lượng dung dịch axít trên . Hãy tính :a)...
Đọc tiếp
Câu 1: Cho 11,2 gam Fe tác dụng với dung dịch HCl .Tính:
a. Thể tích khí H2 thu được ở đktc.(ĐS:4,48 lít)
b. Khối lượng HCl phản ứng.(ĐS:14,6 g)
c. Khối lượng FeCl2 tạo thành.(ĐS:25,4 g)
Câu 2 : Sắt tác dụng axit clohiđric : Ta có phương trình hóa học sau : 
Nếu 1,4g Fe tham gia phản ứng hết với lượng dung dịch axít trên .
Hãy tính :
a) Khối lượng axit Clohđric cần dùng .(1,825g)
b) Thể tích khí H2 thu được đktc .(0,56 lít)
Câu 3: Cho phản ứng: . Biết có 2,4.1022 nguyên tử Al phản ứng.
. Biết có 2,4.1022 nguyên tử Al phản ứng.
a. Tính thể tích khí O2 đã tham gia phản ứng ở đktc. Từ đó tính thể tích không khí cần dùng . Biết khí oxi chiếm 1/5 thể tích của không khí.( ĐS: 0,672 lít; 3,36 lít)
b. Tính khối lượng Al2O3 tạo thành.(ĐS: 2.04 g)
Câu 4: Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2  SO2 . Hãy cho biết:
SO2 . Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất ? Vì sao ?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.(ĐS: 33.6 lít)
c) Khí sunfurơ nặng hay nhẹ hơn không khí


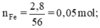
1/ Fe +2 HCl --------> FeCl2 + H2
\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{H_2}=n_{Fe}=0,05\left(mol\right)\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
\(n_{HCl}=2n_{Fe}=0,1\left(mol\right)\Rightarrow m_{HCl}=0,1.36,5=3,65\left(g\right)\)
Câu 6 :
1) $n_{Fe} = \dfrac{2,8}{56} = 0,05(mol)$
Fe + 2HCl → FeCl2 + H2
0,05...0,1....................0,05......(mol)$
$V_{H_2} = 0,05.22,4 = 1,12(lít)$
$m_{HCl} = 0,1.36,5 = 3,65(gam)$
2)
a) $CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$V_{O_2} = 2V_{CH_4} = 4(lít)$
b) $n_{CO_2} = n_{CH_4} = 0,15(mol) \Rightarrow V_{CO_2} = 0,15.22,4 = 3,36(lít)$
c) $d_{CH_4/kk} = \dfrac{16}{29} = 0,552$
Vậy khí metan nhẹ hơn không khí 0,552 lần