Cho 13.44lít Clo (đktc) đi qua 2.5lít KOH ở 1000C sau khi phản ứng xảy ra hoàn toàn thu được 37.25g KCl ,dung dịch KOH trên có nồng độ là bao nhiêu ?
Mấy bạn gửi câu trả lời giùm mình nhé ,mình cảm ơn :)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nCl2 = 0,6 mol, nKCl = 0,5 mol
Phản ứng với KOH ở 100 độ C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,6 mol 0,5 mol
Từ PT ⇒ Cl2 dư nên số mol KOH tính theo số mol KCl
⇒ nKOH = 0,6 mol ⇒ CM(KOH)= 0,24 M

Đáp án D
nKCl = 35,25/74,5 = 0,5 mol; nCl2 = 13,44/22,4 = 0,6 mol
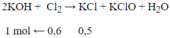
CM KOH =1/2,5=0,4 M

Chọn D. nAgCl=nKCl= 0,5 mol
3Cl2 + 6KOH -> 5KCl + KClO3 + 3H2O
nKCl = 0,5 mol
=> nKOH = 0,6 mol
=> CM KOH = 0,6/2,5 = 0,24 M

Ta có :
\(n_{Cl2}=\frac{1,456}{22,4}=0,065\left(mol\right)\)
\(n_{KCl}=\frac{37,25}{74,5}=0,5\left(mol\right)\)
\(PTHH:3Cl_2+6KOH\rightarrow5KCl+KClO_3+3H_2O\)
_______0,065___0,13 ______________
\(\Rightarrow CM_{dd\left(KOH\right)}=\frac{0,13}{0,5}=0,26M\)

Đáp án CaCO3 = 17,5 gam . Em ra kết quả vậy thì đúng rồi.
nCO2 = \(\dfrac{4,48}{22,4}\)= 0,2 (mol)
nCa(OH)2 =0,15.1= 0,15 (mol)
=> CO2 dư.Hòa tan 1 phần kết tủa
CO2+Ca(OH)2 ---> CaCO3+H2O (1)
CO2+CaCO3+H2O ---> Ca(HCO3)2 (2)
nCO2=nCaCO3=nCa(OH)2=0,15 (mol)
nCO2 (2) =0,2 - 0,15=0,05 (mol)
nCaCO3 (2) =nCO2=0,05 (mol)
=> nCaCO3(1)=0,15-0,05=0,1(mol)
mCaCO3 thu được = 0,1.100=10 (g)
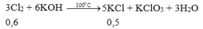

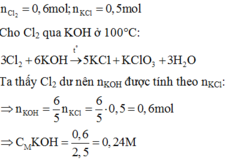
Cl2 + 2KOH ---> KCl + KClO + H2O
nCl2 = 0,6 mol; nKCl = 0,5 mol.
Số mol KOH = 2nKCl = 1,0 mol. Nên nồng độ KOH = 1/2,5 = 0,4M.