Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Vì pX + pY = 23 nên X và Y là những nguyên tố thuộc chu kì nhỏ
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp
=> số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9
Ta xét từng trường hợp
Nếu px - py = 1 => pX =12 (Mg), pY =11 (Na)
ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau (loại)
Nếu pX - pY =7 => pX =15 (P), pY =8(O)
ở trạng thái đơn chất hai nguyên tố phản ứng được với nhau (nhận)
Nếu pX - pY =9 => pX =16 (S), pY =7(N)
ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau (loại)
Vậy X là P

Đáp án D
Vì hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn và A thuộc nhóm VA
Nên B thuộc nhóm IVA hoặc nhóm VIA
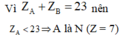
A là P (Z = 15)
+) Khi A là N thì ![]() là S thuộc nhóm VIA.
là S thuộc nhóm VIA.
Ở trạng thái đơn chất, N2 và S không phản ứng với nhau.
Do đó cặp nguyên tố N và S thỏa mãn.
+) Khi A là P thì ![]() là O thuộc nhóm VIA.
là O thuộc nhóm VIA.
Ở trạng thái đơn chất P và O2 có phản ứng với nhau.
Do đó cặp nguyên tố P và O không thỏa mãn.

Đáp án D
Vì hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn và A thuộc nhóm VA
Nên B thuộc nhóm IVA hoặc nhóm VIA.
Vì Z A + Z B = 23 nên Z A < 23
⇒ A là N (Z = 7) A là P (Z = 15)
+) Khi A là N thì Z B = 23 - 7 = 16
là S thuộc nhóm VIA.
Ở trạng thái đơn chất, N2 và S không phản ứng với nhau.
Do đó cặp nguyên tố N và S thỏa mãn.
+) Khi A là P thì
Z B = 23 - 16 = 8 là O thuộc nhóm VIA.
Ở trạng thái đơn chất P và O2 có phản ứng với nhau.Do đó cặp nguyên tố P và O không thỏa mãn.

Đáp án D
Hai nguyên tố thuộc cùng một nhóm A, thuộc hai chu kỳ liên tiếp = Điện tích hạt nhân cách nhau 8, 18 hay 32
Trường hợp 1:
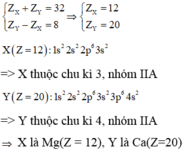
Trường hợp 2:
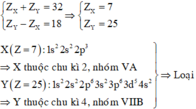
Trường hợp 3:
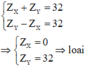

Gọi \(Z_X,Z_Y\) là điện tích của hạt nhân X,Y.
Tổng điện tích hạt nhân : \(Z_X+Z_Y=52\)(1)
X và Y thuộc hai chu kì liên tiếp nên xảy ra 2 trường hợp:
\(\left[{}\begin{matrix}Z_X-Z_Y=8\\Z_X-Z_Y=18\end{matrix}\right.\)
TH1: \(Z_X-Z_Y=8\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}Z_X=30\\Z_Y=22\end{matrix}\right.\)
\(X\left(Z=30\right):\left[Ar\right]3d^{10}4s^2\)\(\Rightarrow\)X nằm ở ô thứ 30, chu kì 4 nhóm llB.
\(Y\left(Z=22\right):\left[Ar\right]3d^24s^2\)\(\Rightarrow\) Y nằm trong ô thứ 22, chu kì 4 nhóm lllB.
Vậy TH này loại vì cùng thuộc 1 chu kì.
TH2: \(Z_X-Z_Y=18\) (3)
Từ (1) và (3) \(\Rightarrow\left\{{}\begin{matrix}Z_X=35\\Z_Y=17\end{matrix}\right.\)
\(X\left(Z=35\right):\left[Ar\right]3d^{10}4s^24p^5\)\(\Rightarrow\)X nằm trong ô thứ 35, chu kì 4 nhóm VllA.
\(Y\left(Z=17\right):\left[Ne\right]3s^23p^5\)\(\Rightarrow\) Y nằm trong ô thứ 17 chu kì 3 nhóm VllA.
Vậy TH này thỏa mãn ycbt.

Đáp án C
Vì X và Y thuộc cùng một nhóm A và ở chu kì liên tiếp nên ta có:
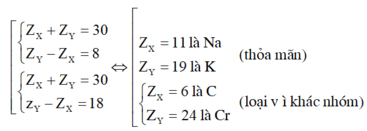
Khi đó cấu hình electron là của Na là 1s22s22p63s1

Đáp án C
Vì X và Y thuộc cùng một nhóm A và ở chu kì liên tiếp nên ta có:
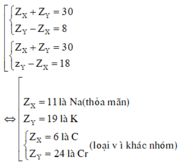
Khi đó cấu hình electron là của Na là 1s22s22p63s1.


D
Vì
nên X và Y là những nguyên tố thuộc chu kì nhỏ.
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp
=> Số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9.
Ta xét từng trường hợp:
Nếu
Ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau(loại).
Nếu
Ở trạng thái đơn chất hai nguyên tố này phản ứng được với nhau (nhận).
Nếu
Ở trạng thái đơn chất hai nguyên tố này không phản ứng với nhau(loại).
Vậy X là P.