Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
Ba + 2H2O -> Ba(OH)2 + H2
Ba(OH)2 + 2Al + H2O -> Ba(AlO2)2 + 3H2
=> nH2 = 4nBa = 0,4 mol => nBa = 0,1 mol
Vì X +NaOH tạo nH2 = 0,7 mol > 0,4 mol => chứng tỏ Al dư ở thí nghiệm đầu
=> nH2 do Al = nH2 (2) – nH2(1) = 0,3 mol
=> nAl = 2/3 nh2 do Al = 0,2 mol
=> mX = 19,1g

Chọn đáp án D
Do VH2 thu được ở 2 thí nghiệm khác nhau ⇒ Al dư ở thí nghiệm 1.
Đặt nNa = x; nAl = y. ● Xét thí nghiệm 1: Na → NaOH → NaAlO2.
⇒ nAl phản ứng = nNa = x. Bảo toàn electron: x + 3x = 2 × 0,4 ⇒ x = 0,2 mol.
● Xét thí nghiệm 2: Do NaOH dư ⇒ Al tan hết. Bảo toàn electron:
x + 3y = 2 × 0,55 ⇒ y = 0,3 mol. ||► m = 0,2 × 23 + 0,3 × 27 = 12,7(g)

Đáp án C
Khi cho X vào H2O thì thu được 0,4 mol H2 còn khi cho vào NaOH thì thu được 0,55 mol H2 chứng tỏ khi cho vào H2O thì NaOH dư.
Gọi số mol Na và Al lần lượt là a, b
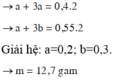

Đáp án D
Nhận thấy khi cho vào nước lượng H2 nhỏ hơn khi cho vào NaOH. Do vậy khi cho X vào nước thì Al dư.
Gọi số mol Na là x, Al là y.
Khi cho X vào nước, Al dư nên số mol Al phản ứng bằng số mol Na x+x.3 = 0,4.2
Cho X vào NaOH thì cả 2 phản ứng hết → x+3y=0,55.2
Giải được: x = 0,2; y = 0,3 → m = 12,7 gam

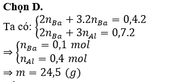


Đáp án C