Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Ta thấy cốc nước có chứa các ion Ca2+, Mg2+, HCO3-, Cl- => đây thuộc nước cứng toàn phần
Đáp án B

Giải thích:
Bảo toàn điện tích: 2nCa2+ + nK+ = nCl- + nHCO3-
=> 0,2 + a = 0,15 + b
=> b – a = 0,05 ( mol) (1)
Thêm vào cốc 0,1 mol Ca(OH)2 thì dung dịch thu được chỉ chứa 1 muối duy nhất => muối đó là KCl
=> nK+ = nCl- = 0,15 (mol) = a
Từ (1) => b = nHCO3- = 0,05 + 0,15 = 0,2 (mol)
Khi đun sôi nước cứng trên thì:
2HCO3- → CO32- + CO2 + H2O
0,2 → 0,1 (mol)
=> nCO3 2- = 0,1 (mol)
=> mrắn = mCa2+ + mCO32- + mK+ + mCl-
= 0,1. 40 + 0,1.60 + 0,15.39 + 0,15. 35,5
= 21,175 (g)
Đáp án B

Đáp án B
Đặt nHCO3– = a và nCa(OH)2 thêm vào = b.
⇒ ∑nCa2+ = nHCO3– ⇔ 0,1 + b = a ⇔ a – b = 0,1 (1)
Để dung dịch chứa 1 muối duy nhất ⇒ nHCO3– = nOH–
⇔ a = 2b ⇔ a – 2b = 0 (2).
+ Giải hệ (1) và (2) ⇒ nHCO3– = a = 0,2 mol.
Bảo toàn điện tích ⇒ nK+ = 0,15 mol.
+ Khi nung thì 2HCO– → CO32– + CO2↑ + H2O.
⇒ 0,2 mol HCO3– sẽ thay thế bằng 0,1 mol CO32–.
Vây cô cạn dung dịch
mMuối = 0,1×40 + 0,15×39 + 0,15×35,5 + 0,1×60 = 21,175 gam.

Nước cứng là chứa các cation \(Ca^{2+};Mg^{2+}\) mà nước này không có nên đây là nước mềm.
Bảo toàn điện tích
\(n_{Na^+}=n_{HCO3^-}+2n_{SO_4^3}+n_{Cl^-}\)
\(\Rightarrow0,4=0,05+0,15.2+x\)
\(\Rightarrow x=0,05\)

Đáp án B
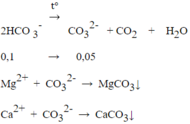
Vì lượng CO32- không đủ để kết tủa hết ion Mg2+ hoặc Ca2+ nên trong dung dịch thu được sau phản ứng chứa Na+, Mg2+, Ca2+, Cl- , SO42- đó là nước cứng vĩnh cửu

Đáp án B
2HCO3- → CO32- + CO2 + H2O
0,1 → 0,05
Mg2+ + CO32- → MgCO3↓
Ca2+ + CO32- → CaCO3↓
Vì lượng CO32- không đủ để kết tủa hết ion Mg2+ hoặc Ca2+ nên trong dung dịch thu được sau phản ứng chứa Na+, Mg2+,
Ca2+, Cl- , SO42- đó là nước cứng vĩnh cửu
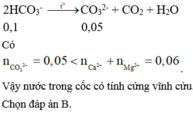
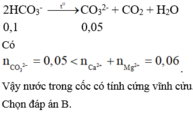
Đáp án C.
Cốc nước trên chứa các ion: Ca2+, Mg2+, HCO3-, Cl-
⇒ Thuộc nước cứng toàn phần (có cả tính cứng tạm thời và tính cứng vĩnh cửu)