Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Giả sử có 1 mol hỗn hợp đầu. Gọi x và y (mol) lần lượt là số mol của N₂ và H₂ trong 1 mol hỗn hợp đầu
Gọi n₁, P₁ và n₂, P₂ lần lượt là số mol hỗn hợp khí + áp suất trong bình ban đầu và lúc sau
⇒ n₁ = x + y = 1 (1)
Khi nhiệt độ không đổi
⇒ n₁ / n₂ = P₁ / P₂
Áp suất khí trong bình giảm 5% so với áp suất ban đầu ⇒ P₁ / P₂ = 20 / 19
⇒ n₁ / n₂ = 20 / 19 (2)
Số mol của nito đã phản ứng là 10% ⇒ N₂ pứ 0,1x mol
N₂ + 3H₂ → 2NH₃
Trước: x y 0
Pứ 0,1x 0,3x 0,2x
Sau: n N₂ = 0,9x ; n H₂ = y - 0,3x ; n NH₃ = 0,2x
⇒ n₂ = 0,9x + y - 0,3x + 0,2x
⇒ n₂ = 0,8x + y (3)
Từ (1) (2) & (3) ta có:
(x + y) / (0,8x + y) = 20 / 19
⇒ 3x - y = 0 (4)
Giải hệ (1) & (4) cho ta: x = 0,25 mol và y = 0,75 mol
Thành phần phần trăm về số mol của N₂ và H₂ trong hỗn hợp đầu là:
%N₂ = 25% và %H₂ = 75%

Chọn B
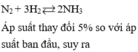
Áp suất thay đổi 5% so với áp suất ban đầu => n s a u n t r ư ớ c = 95 100
Giả sử trước phản ứng có 1 mol => sau phản ứng có 0,95 mol
ntrước – nsau = 2nN2 pư = 0,05 mol
è nN2 ban đầu = 0,025:10% = 0,25 =>%nN2 = 25%

Đáp án D.
N2+ 3H2 ⇌ 2NH3
Dựa vào công thức: PV=nRT
Ở nhiệt độ và thể tích không đổi (thể tích bình chứa luôn là 4 lít) và R là hằng số thì áp suất (P) tỉ lệ với số mol (n)
Theo đề áp suất sau bằng 9/10 áp suất ban đầu
→nkhí sau pứ= 9/10.nkhí ban đầu= 9/10. (8+16)= 21,6 mol
nNH3= nkhí trước pứ- nkhí sau pứ= (8+16)- 21,6= 2,4 mol

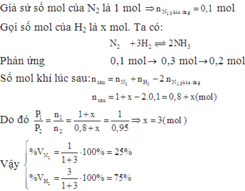
 A.
A.

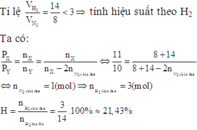
Đáp án B