Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

SO2 + Br2 + H2O ---> 2HBr + H2SO4
H2SO4 + BaCl2 ---> BaSO4 + 2HCl
nBaSO4 = 2,796/233 = 0,012 mol = nSO2.
Gọi x, y tương ứng là số mol Cu và Ag.
Áp dụng bảo toàn e: 2x + y = 2.0,012 và 64x + 108y = 1,68. Giải hệ thu được: x = 0,006 và y = 0,012 mol.
1) mCu = 64.0,006 = 0,384 g; mAg = 108.0,012 = 1,296 g;
2) nH2SO4 p.ư = nSO4(muối) + nSO2 = x + y/2 + 0,012 = 0,024 mol.
Vì có 10% axit p.ư nên nH2SO4 ban đầu = 0,24 mol. Suy ra: %H2SO4 = 98.0,24/29,4 = 80%.

HD:
Câu 1.
Fe + 2HCl ---> FeCl2 + H2 (1)
FexOy + 2yHCl ---> xFeCl2y/x + yH2O (2)
Gọi a, b tương ứng là số mol của Fe và FexOy trong hh. Theo pt (1) số mol a = số mol H2 = 0,1 mol. Số mol HCl đã p.ứ ở pt (1) = 0,2 mol.
Số mol HCl ban đầu = 14,6.200/100.36,5 = 0,8 mol.
Khối lượng dd A = 200 + 17,2 - 2.1 = 215,2 g. Khối lượng dd B = 215,2 + 33 = 248,2 g.
Số mol HCl còn dư sau phản ứng = 2,92.248,2/100.36,5 = 0,19856 mol \(\approx\) 0,2 mol. Như vậy số mol HCl đã tham gia p.ứ = 0,8 - 0,2 = 0,6 mol.
Mà HCl đã p.ứ ở pt (1) là 0,2 mol nên số mol HCl đã p.ứ ở pt(2) là 0,4 mol.
Theo pt(2) số mol FexOy = 0,4/2y = 0,2/y mol. Mà khối lượng FexOy = 17,2 - 5,6 = 11,6 g. Ta có: (56x + 16y).0,2/y = 11,6. Suy ra: 56x + 16y = 58y hay x:y = 3:4
Oxit cần tìm là: Fe3O4.

Hỗn hợp khí Y gồm H2 (x mol) và NO (y mol, hóa nâu trong kk).
Ta có: x + y = 0,125 mol và 2x + 30y = 12,2.2.0,125 = 3,05. Giải hệ thu được: x = 0,025 và y = 0,1 mol.
Zn + 2HCl ---> ZnCl2 + H2 (1)
x x x
3Zn + 8H+ + 2NO3- ---> 3Zn2+ + 2NO + 4H2O (2)
1,5y 1,5y y
a) Số mol Zn đã tham gia phản ứng = x + 1,5y = 0,175 mol. Khối lượng Zn = 65.0,175 = 11,375 gam.
b) Muối sau phản ứng gồm ZnCl2 (x mol) và Zn(NO3)2 (=số 1/2 số mol NO3- = 0,075 mol). Nên m = 135.0,025 + 189.0,075 = 17,55 gam.

2yAl + 3FexOy ---> yAl2O3 + 3xFe (1) Chất rắn B gồm Al2O3, Fe và Al dư (vì phản ứng xảy ra hoàn toàn nên FexOy không dư).
0,08 0,04 0,08
Al(dư) + NaOH + H2O ---> NaAlO2 + 3/2H2 (2)
0,02 0,02 0,03 mol
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O (3) Phần không tan D là Fe.
NaAlO2 + HCl + H2O ---> Al(OH)3\(\downarrow\)+ NaCl (4)
2Al(OH)3 ---> Al2O3 + 3H2O (5) (5,1 gam chất rắn là Al2O3).
0,1 0,05 mol
2Fe + 6H2SO4 ---> Fe2(SO4)3 + 3SO2\(\uparrow\) + 6H2O (6)
0,08 0,12 mol
Theo pt(4) và (5) số mol NaAlO2 = số mol Al(OH)3 = 0,1 mol. Do đó số mol NaAlO2 ở pt (3) = 0,1 - 0,02 = 0,08 mol. Suy ra số mol Al2O3 sinh ra ở pư (1) = 0,04 mol.
Theo pt(6) số mol Fe = 0,08 mol. Như vậy, từ pt (1) ta có: 2y = 3x hay x/y = 2/3. Suy ra: Fe2O3.
m = mAl + mFe2O3 = 27(0,08 + 0,02) + 160.0,04 = 9,1 gam.



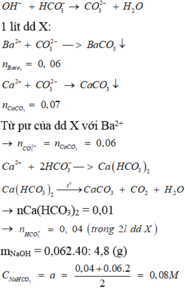
a) Gọi R là kí hiệu và cũng là NTK của kim loại kiềm
số mol NaHCO3 = 4,2 : 84 = 0,05 (mol)
Muối R2SO4 không p/ư với NaHCO3.--> muối đem dùng là RHSO4.
2RHSO4 + 2NaHCO3 -->Na2SO4 + R2SO4 + 2H2O + 2CO2 (khí)
0,05 mol ...0,05 mol …..0,025 mol.....0,025 mol…….....0,05 mol
Khối lượng dung dịch A giảm là do khí CO2 thoát ra.
-Khi thêm 0,1 mol BaCl2 vào dd A vẫn còn dư SO4(2-),
Chứng tỏ số mol SO4(2-) > 0,1 (mol)
-Thêm tiếp 0,02 mol BaCl2 vào dd A thì dư BaCl2 ,
như vây số mol SO4(2-) < 0,12 (mol)
Na2SO4 + BaCl2 ------> 2NaCl + BaSO4
0,05...<---...0,05...--->....0,1..--->...
NaHSO4 + BaCl2 ---->BaSO4(rắn) + HCl + NaCl
0,06...<---... 0,06...--->....0,06...--->...0,06...0,06
=> (R + 97).0,1< 13,2 < (R + 97).0,12
Hay 13 < R < 35. Chỉ có kim loại Na là thỏa mãn.
Vậy muối sunfat kim loại kiềm là NaHSO4.
b) Số mol NaHSO4 ban đầu = 13,2 : 120 = 0,11 (mol)
*Nồng độ % các chất tan trong dung dịch A:
Khối lượng dd A = 100 + 100 – 0,05.44 = 197,8 (g)
Chất tan trong dd A: mNa2SO4 = 0,05. 142 = 7,1 (g) => C% Na2SO4 = 3,59 %
0,11 – 0,05 = 0,06 mol NaHSO4 dư --> mNaHSO4 dư = 7,2 (g)
=> C% NaHSO4 dư = 3,64 %.
*Nồng độ % các chất tan trong dung dịch D:
Khối lượng dd D = mdd A + 100 + 20 – 0,11.233 = 292,17 (g)
Chất tan trong dd D:
0,11 + 0,05 = mol NaCl; Khối lượng NaCl = 0,16. 58,5 = 9,36 (g)
=> C% NaCl = 3,2% ;
- nBaCl2 dư = 0,01 (mol)--> Khối lượng BaCl2 dư = 2,08 (g)
=> C% BaCl2 (dư) = 0,71%
-Số mol HCl = 0,06 (mol)-->Khối lượng HCl = 2,19 (g)
=> C% HCl = 0,75 %.
A