
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

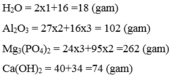

1/
a, Xét 1 phân tử chất:
\(m_C=16.75\%=12\Rightarrow\) Có 1 C
\(m_H=16-12=4\Rightarrow\) Có 4 H
\(\Rightarrow CH_4\)
b, Xét 1 phân tử chất:
\(m_S=34,12\%=32\Rightarrow\) Có 1 S
\(m_H=34-32=2\Rightarrow\) Có 2 H
\(\Rightarrow H_2S\)
c, Xét 1 phân tử chất:
\(m_H=98.3,06\%=3\Rightarrow\) Có 3 H
\(m_P=98.31,63\%=31\Rightarrow\) Có 1 P
\(m_O=98-3-31=64\Rightarrow\) Có 4 O
\(\Rightarrow H_3PO_4\)
d, Xét 1 phân tử chất:
\(m_{Al}=342.15,79\%=54\Rightarrow\) Có 2 Al
\(m_S=342.28,07\%=96\Rightarrow\) Có 3 S
\(m_O=342-54-96=192\Rightarrow\) Có 12 O
2/
- C1:
Giả sử có 100g chất
\(m_C=82,76\left(g\right);m_H=17,24\left(g\right)\)
\(n_C=6,9\left(mol\right);n_H=17,24\left(mol\right)\)
\(n_C:n_H=2:5\)
CTĐGN (C2H5)n
\(M=29.2=58\)
\(\Rightarrow n=2\Rightarrow C_4H_{10}\)
- C2:
Xét 1 phân tử nặng 2.29= 58:
\(m_C=58.82,76\%=48\Rightarrow\) Có 4 C
\(m_H=58-48=10\Rightarrow\) Có 10 H
\(\Rightarrow C_4H_{10}\)

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

Bài 2
\(\%Na:\%O:\%H=57:40:3\)
\(\Rightarrow n_{Na}:n_O:n_H=\frac{57}{23}:\frac{40}{16}:\frac{3}{1}\)
\(=2,48:2,5:3\approx1:1:1\)
\(\Rightarrow CTHH:NaOH\)
Bài 3
\(Fe2O3+6HCl-->2FeCl3+3H2O\)
\(n_{FE2O3}=\frac{48}{160}=0,3\left(mol\right)\)
\(n_{FeCl3}=2n_{Fe2O3}=0,6\left(mol\right)\)
\(m_{FeCl3}=0,6.133,5=80,1\left(g\right)\)
\(n_{HCl}=6n_{Fe2O3}=1,8\left(mol\right)\)
\(m_{HCl}=1,8.36,5=65,7\left(g\right)\)

Bài 1:
Gọi CTHH của oxit là \(A_xO_y\) ( x,y là những số nguyên dương đơn giản )
Vì \(M_{A_xO_y}=160\left(g/mol\right)\)
\(\Rightarrow x.M_A+16y=160\left(g/mol\right)\)
\(\%m_A=70\%\Rightarrow\dfrac{x.M_A}{160}.100\%=70\%\)
\(\Rightarrow x.M_A=112\)
Ta có bảng thử các giá trị của x:
| x | 1 | 2 | 3 |
| \(M_A\) | 112 | 56 | 37,3 |
⇒ x = 2 ; MA = 56 ⇒ Kim loại là Fe
\(y=\dfrac{160-112}{16}=3\)
Vậy CTHH : \(Fe_2O_3\)
Bài 2:
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{60}{102}=0,59\left(mol\right)\)
PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tỉ lệ : \(\dfrac{0,59}{1}>\dfrac{0,5}{3}\)
→ Nhôm oxit dư, tính theo H2SO4
Theo PTHH : \(n_{Al_2O_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3p/ư}=\dfrac{1}{6}.102=17\left(g\right)\)
\(\Rightarrow m_{Al_2O_3dư}=60-17=43\left(g\right)\)
Theo PTHH: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{AL_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)

1) Hợp chất a, c, f
2) Oxit axit: P2O5, SO2, Mn2O7
Oxit bazơ: BaO, Na2O, CuO, Al2O3
3)
BaO: Bari oxit
P2O5: điphotpho pentaoxit
K2O: Kali oxit
CuO: Đồng (II) oxit
4) Khối lượng đồng trong oxit là \(80.80\%=64\left(g\right)\)
=> \(n_{Cu}=\frac{64}{64}=1\left(mol\right)\)
Khối lượng oxi trong oxit là \(80-64=16\left(g\right)\)
=> \(n_O=\frac{16}{16}=1\left(mol\right)\)
=> CTHH: CuO

1a, \(n_{H_2O}=\dfrac{m}{M}=\dfrac{9}{2.1+16}=0,5\left(mol\right)\)
b,\(n_{Mg\left(NO_3\right)_2}=\dfrac{m}{M}=\dfrac{29,6}{24+2.14+2.3.16}=\dfrac{29,6}{148}=0,2\left(mol\right)\)
2, a, \(V_{SO_2}=n.22,4=0,4.22,4=8,96\left(l\right)\)
b,\(V_{CO_2}=n.22,4=4,4.22,4=98,56\left(l\right)\)
c, \(n_{O_2}=\dfrac{1,5.10^{23}}{6.10^{23}}=0,25\left(mol\right)\)
\(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
3, a, \(m_{Al_2O_3}=n.M=1,2.\left(2.27+3.16\right)=122.4\left(g\right)\)
b,\(n_{NO_2}=\dfrac{V}{22,4}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(m_{NO_2}=n.M=0,6.\left(14+2.16\right)=27,6\left(g\right)\)
4, \(n_A=\dfrac{V}{22,4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
\(M_A=\dfrac{m}{n}=\dfrac{4,25}{0,25}=17\left(g\text{/}mol\right)\)

1.
\(M_{H2O}=2M_H+M_O=2.1+16=18\left(đvC\right)\)
\(M_{Al2O3}=2M_{Al}+3M_O=2.217+3.16=102\left(đvC\right)\)
\(M_{Mg3\left(PO4\right)2}=3m_{Mg}+2M_P+8M_O=2.34+2.31+8.16=262\left(đvC\right)\)
\(M_{Ca\left(OH\right)2}=M_{Ca}+2M_O+2M_H=1.40+2.16+2.1=74\left(đvC\right)\)
2.
Ta có: \(M_{MgO}=M_{Mg}+M_O=24+16=40\)
\(\rightarrow\%_{Mg}=\frac{24}{40}=60\%\rightarrow\%_O=40\%\)
\(M_{Fe2O3}=2M_{Fe}+3M_O=56.2+16.3=160\)
\(\rightarrow\%_{Fe}=\frac{56.2}{160}=70\%\rightarrow\%_O=30\%\)
3.
\(n_{SO3}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{SO3}=0,2.80=16\left(g\right)\)
\(n_{CH4}=\frac{6,4}{16}=0,4\left(g\right)\)
\(V_{CH4}=0,4.22,4=8,96\left(l\right)\)
4.
\(M_{Al2\left(SO4\right)3}=342\)
5.
Gọi công thức A là FexOy
Ta có \(x+y=7\)
Lại có \(M_A=232\)
\(\rightarrow56x+16y=232\)
\(\rightarrow\left\{{}\begin{matrix}x=3\\y=4\end{matrix}\right.\)
Vậy A là Fe3O4

Bài 1
nP = \(\dfrac{m}{M}=\dfrac{15,5}{31}=0,5\left(mol\right)\)
\(nO_2=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Ptr: 4P + 5O2 \(\underrightarrow{t^o}2P_2O_5\)
4......5...........2
0,4\(\leftarrow\)0,5 \(\rightarrow\) 0,2
Vì \(\dfrac{0,5}{4}>\dfrac{0,5}{5}\left(nP>nO_2\right)\)
\(\Rightarrow\)n P dư: 0,5- 0,4= 0,1 (mol)
suy ra: tính theo n O2
Khối lượng Photpho dư là:
mP dư = n dư .M =0,1.31= 3,1(g)
Khối lượng P2O5 thu được là:
mP2O5 = n.M= 0,2.142= 28,4(g)
Bài 2
a)
n KClO3 = \(\dfrac{m}{M}=\dfrac{24,5}{122,5}=0,2\left(mol\right)\)
Ptr:
2KClO3 \(\underrightarrow{t^o}2KCl+3O_2\uparrow\)
2...............2...........3
0,2 \(\rightarrow\) 0,2 \(\rightarrow\) 0,3
Thể tích khí oxi thu được là
V O2 = n.22,4= 0,2.22,4=4,48(l)
b)
nCH4 = \(\dfrac{V}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Ptr:
CH4 + 2O2 \(\underrightarrow{t^o}CO_2+2H_2O\)
1..........2..........1...........2
0,15 \(\leftarrow\) 0,3 \(\rightarrow\) 0,15 \(\rightarrow\) 0,3
Vì 0,15<0,4
\(\rightarrow\)n CH4 dư : 0,4- 0,15=0,35(mol)
suy ra : tính theo n O2
Khối lượng CO2 thu được là:
m CO2 =n.M = 0,15.44=6,6(g)
Khối lượng H2O thu được là:
m H2O = n.M = 0,3.18=5,4(g)
Bài 3
a)
n Fe2O3= \(\dfrac{m}{M}=\dfrac{48}{160}=0,3\left(mol\right)\)
Ptr:
Fe2O3 + 3H2 \(\rightarrow\) 2Fe + 3H2O
1............3..........2.........3
0,3..\(\rightarrow\)..0,9..\(\rightarrow\).0,6.\(\rightarrow\)..0,9
khối lượng nước thu được là:
m H2O =n.M = 0,9.18= 16,2(g)
b)
n H2SO4= CM.V= 0,2.3,5=0,7(mol)
Ptr:
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2\(\uparrow\)
1..........1.............1..........1
0,6\(\rightarrow\)0,6 ......\(\rightarrow\)0,6..\(\rightarrow\)0,6
Vì 0,6< 0,7
nên n H2SO4 dư: 0,7-0,6= 0,1mol
suy ra phải tính theo n Fe
* Thể tích H2 thu được là:
V H2= n.22,4 = 0,6.22,4=13,44(l)
* cái này mình k chắc nên không giải bn tự giải né

nCO2= 1.76/44=0.04 mol
nH2O= 1.08/18=0.06 mol
a) nC(trong CO2) = nCO2 = 0.04 mol
=> mC(trong CO2) =0.04*12=0.48g
b) %mC = \(\dfrac{0.48}{1.24}\cdot100\) = 38.41%
c) nH=nH2O =0.06 mol
mH= 0.06*2 =0.12 g
d) %mH= \(\dfrac{0.12}{1.24}\cdot100\) = 9.68%
e) mO = mhợp chất -( mH +mO) = 1.24-(0.48+0.12) = 0.64g
%mO= \(\dfrac{0.64}{1.24}\cdot100\) =51.61%
f) Gọi công thức đơn giản nhất của hợp chất là CxHyOz
nC= 0.04 mol
nH=0.12 mol
nO=0.04 mol
Ta có : x:y:z = 0.04 : 0.12: 0.04 =1:3:1
Suy ra, công thức đơn giản nhất của hợp chất là CH3O
Gọi công thức phân tử của hợp chất là : (CH3O)n
PTKhợp chất = (12+3+16)n=62
=>n= 2
Vậy CTPT của hợp chất là C2H6O2 (etylen glicol)
Nếu bạn chưa học tới hóa học hữu cơ, ko biết CTPT thì viết C2H6O2 là CTHH cx đc :)